フッ化水素酸はガラスを溶かすことのできる酸として非常に有名です.
フッ化水素酸はどのように発見されたのでしょうか?

今回はフッ化水素酸の危険と向き合い,これを利用してきた化学の歴史を見てみましょう.
酸の歴史(1):酸とはなにか?
酸の歴史(2):錬金術と硫酸
酸の歴史(3):鉛室法の発明
酸の歴史(4):染料と接触法
酸の歴史(5):硝酸と硝石
酸の歴史(6):オストワルト法
酸の歴史(7):塩酸
酸の歴史(8):リン酸
酸の歴史(9):フッ化水素酸
1.蛍石とガラス
蛍石CaF2は世界的に広範囲で産出する鉱物で,不純物によって黄色や緑,紫色など様々な色に着色しています.
蛍石は古くから冶金の融剤として使われていました.

ドイツの鉱山町で医者として活躍した鉱山学の父,アグリコラ(Georgius Agricola, 1494-1555) は蛍石CaF2を含むであろう鉱石についてこのような記述を残しています.
鉱夫たちはこれを”流動石 (fluores)"と呼んでいます.というのは,それらはまるで太陽に当たった氷のように炎の熱によって液状となり流動するからです.(中略) それらは火中にいれた素材の流動性をいっそう増すので,ふつう金属を溶融するときに使われています.
蛍石中のフッ素原子FはSiO2のネットワークを部分的に破壊してスラグの流動性を高めるため,鉄の精錬などに使われました.
蛍石から得られる酸でガラスを溶かすことができることは17世紀には知られていたようです.
1670年にはニュルンベルクのシュヴァンハルト (Heinrich Schwanhard, 1625-1693) が,蛍石から得たフッ化水素酸でガラス上に図柄を描くエッチングと呼ばれる技法を完成させました.
17世紀は,ちょうどガラス製造技術が進化を遂げた時代で,数多くの錬金術師たちがガラス製造レシピの改良に取り組んでいました.

最も有名なのはイタリアの司祭・錬金術師Antonio Ludovic Neri (1576-1614) でしょう.著書『L'Arte Vitraria』(1612) は英語やドイツ語に翻訳され,広まりました.
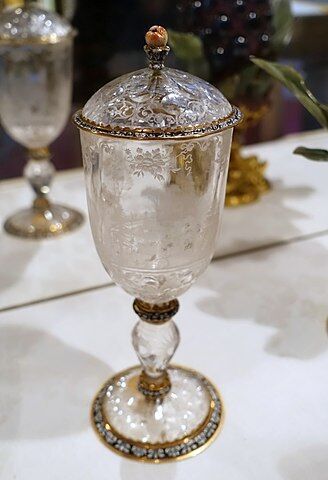
シュヴァンハルトはニュルンベルクのガラス彫刻学校の父とされたGeorg Schwanhardt the Elder (1601–1667) の長男として生まれ,その才能を引き継ぎました.特に彼は遠近法に基づくデッサン力に優れ,父を含め当時のガラス彫刻家をしのぐ才を発揮したとのことです.
シュヴァンハルトも読んだであろうNeriの『L'Arte Vitraria』には,美しい赤色*1のガラス,Rubinglasのレシピが書かれています.

金を王水で何度も焼成し,その上に5,6回水を注ぎ,この金の粉末を土鍋に入れ,炉の中で赤い粉末になるまでに何日も焼成する.この粉末を十分量とり,細かいガラス結晶に加えれば,透明な赤色のルビーが得られる.
このように,ガラスの製造に錬金術師たちが発展させた王水をはじめとした酸が使われていたようです.
酸を使ったガラス関連の技術自体はもっと古くから確認することができます.
例えば14世紀頃,ステンドガラスの制作方法の中には,色ガラスの層を酸で除去し,その下にある別の色の層を浮かび上がらせる手法がありました.

現代のガラスは酸に耐性がありますから「ガラスの層を酸で除去」と聞くと不思議な気がしますが,当時は酸に耐性のあるガラスとは別に,酸に耐性のないガラスも作られていたようです.
一方で,シュヴァンハルトが開発した技術は,酸に耐性のあるガラスでも装飾を施すことのできるものです.
シュヴァンハルトはおそらく偶然*2,薬局に売っていたボヘミアンエメラルド,いわゆる蛍石からフッ化水素酸HFを得た*3のだと考えられています.
生成した酸が,本来酸に耐性のあるはずの眼鏡のレンズを腐食させることを発見し,これをガラスに使おうと考えたようです.
シュヴァンハルトはフッ化水素酸を用いることで多くの装飾や文章,そして風景をガラスにきれいに刻み込み,その技術を芸術の域に高めました.
マイセンが創業する以前のヨーロッパでは,中国から入ってきた磁器はガラスを特殊な方法で加工したものだろうと考えられていました.15世紀に流行したヴェネツィアの乳白ガラス(Lattimo)は,磁器のレシピを発見しようとした試みの中で発明されました.

17世紀ヨーロッパでも,引き続き磁器のレシピが求められており,宮廷に仕える医師もそうした流れに巻き込まれていました.ザクセン公Frederick Augustus 1世 (在位1806-1827)に仕えていた医師パウリ(Matthäus Pauli, 1649?-1704) もその一人です.
フッ化水素酸で処理したガラス表面の質感は磁器と似ていたため,パウリは酸エッチングの技術に興味を持ったのだと思われます.
その後,フッ化水素酸の知識はJohann Georg Weygand (1680-1740)やEhrenfried Walther von Tschirnhaus (1651–1708)に知識が受け継がれ,その内容も出版され公表されました.
しかし当然ですが,これで磁器が作れたわけではありませんでした.
装飾に使うにしても,フッ化水素酸を十分量用意するのは大変だったことや,処理した表面には小さな気泡が入るため細かい模様を描くには扱いづらかったようです.
結果として,シュヴァンハルトの開発した技術はあまり注目されなくなりました.
2.スウェーデン酸

1768年,マルクグラーフ (Andreas Sigismund Marggraf, 1709-1782) は蛍石の化学的な研究を行いました.
当時"Flus-Spaht(蛍石)"と呼ばれた鉱石はたくさんあり,いろんな色をしていました.そこでMarggrafはそれらが同じ性質を示すのかどうか,調べたというわけです.
ザクセン産のFlus-Spahtを加熱したところ,気体が発生し,冷却すると硫酸が生成されました.したがってこの鉱石はなんらかの硫酸塩であり,今でいう蛍石とは異なっていたと考えられます.

一方,緑色のPseudo-Smaragdusとも呼ばれた鉱石からは硫酸を発生させることができませんでした.したがってこれは硫酸塩ではありませんね.
逆に硫酸を入れて加熱したところ,今度はガラス容器が溶けてしまいました.
こちらは現在でいう蛍石だったのでしょう.Marggrafは未知の酸の発生にまでは気づいていませんでした.

1771年,スウェーデンの薬剤師シェーレ (Carl Wilhelm Scheele, 1742-1786) も,スコーネ地方のGarpenberg産の緑色の鉱石やGislof産の白い鉱石を使って同様の現象を確認しました.
シェーレは蒸留器 (レトルト) 側に残った物質が石膏 (硫酸カルシウム)であり,ガラス容器の内側がけずられていることを確認しました.シェーレはこれが未知の酸による作用だと考えました.

また,水を入れていた容器(レシーバー)に白い物質が浮かんでいたのですが,これがシリカSiO2であることを発見しました.
シェーレはこうした現象が硫酸だけでなく,硝酸や塩酸でも起きることも報告しました.
この不思議な酸については国外にも知られ,だいぶ論争を呼んだようです.この酸は,スウェーデン酸とも呼ばれました.
不思議な酸の存在は,今度は広くヨーロッパ中に知られるようになり,再びガラス細工へ応用する動きが出てきました.
例えば1788年,Puymàurin伯爵 (Jean Pierre Casimir de Marcassus de Puymàurin, 1743-1817)はフッ化水素酸によるガラスの装飾技法について詳しく実験し,それを報告しています.

伯爵が調べたところによると,鉛Pbを含むイギリスの透明度が高く美しいクリスタルガラス*4では酸が鉛と反応してしまうので使用が難しく,均一でないボヘミアンガラス*5では酸の作用が安定しなかったそうです.
伯爵は室温にも気を使い,硫酸を用いてつくったフッ化水素酸により,安定してガラスに装飾を施す手順を確立しました.
こうして報告されたフッ化水素酸によるガラスの処理方法はヨーロッパ中に普及しました.リトアニアのMykolas Žilinskas Art Galleryに所蔵されているロシアの帝国工場で作られたガラス瓶には1791年という日付が刻まれています.
19世紀にはさらに普及することになりますが,それにはイギリスの事情が関わっています.
実はイギリスではガラスに対して高い税がかけられていました.そうすると,ガラス作家としては高いガラスを使って新しい技術に挑戦するよりは,無難に作品を作って売りたいですよね.
一方で1845年にはガラス税が撤廃されました.結果としてガラスが安くなりましたので,少しくらい無駄にしても新しい技術にチャレンジしようというマインドが醸成されました.結果としてフッ化水素酸によるエッチングが一気に普及しました.
この頃になるとフッ化水素酸の価格は比較的手頃だったようで,未熟練者でも比較的かんたんに繊細な装飾模様を施すことができたのが普及を後押ししたようです.

3.フッ素の単離

フランスのアンペール (André Marie Ampère, 1775-1836) はフッ化水素酸の性質が塩化水素HClに似ていることに気づき,きっとこれは水素と未知の元素の化合物に違いないと考えました.

アンペールは電気分解によってこの未知の元素,フッ素(le fluore)*6が分離できるのではないかと考え,電気分解の得意なイギリスのデービー (Humphry Davy, 1778-1829) *7にこのアイデアを伝えました.

デービー自身は「水素と未知の元素の化合物である」というアンペールの主張をはじめは信じていなかったようですが,やがて考えを変え,フッ素の単離にトライすることにしました.彼は王立研究所の「すごい強力なヴォルタ電池」を使ってフッ化水素酸を電気分解し,フッ素 (fluorine)を得ようとしました.
電気分解を続けていくと,陽極から目的のガスが発生したように見えましたが,実際には分解されていないフッ化水素酸が揮発しただけでした.デービーはこのガスに接触してしまったため,指の爪の下が痛くなり,数時間ずっと目が痛かったそうです.
なぜ彼は失敗してしまったのでしょう?
デービーは実験中,フッ化水素酸の水分量*8が少なくなると電気抵抗が著しく上昇することに気づいていました*9.電気抵抗が上昇した理由は,フッ化水素が電離しにくく,ほとんど電気を通さなかったたからです.
そのため,「すごい強力なヴォルタ電池」をもってしても,電気が流れにくいためフッ化水素酸を電気分解することができず,熱の発生によりフッ化水素酸が揮発しただけだったというわけでした.
フッ素を単離するには,電気を流しやすくする必要がありました.

数多くの研究者がフッ化水素酸の毒で負傷したり命を落とした中,1854年,フランスの化学者Edmond Frémy (1814-1894) は融解させたフッ化カルシウムCaF2を直接電気分解しようとしました.
融解させたフッ化カルシウムは電気伝導度も高いですので,良いアイデアではありました.
しかしこの実験にはすごい高温が必要でした.高温ではフッ素と白金容器が反応し,
それがさらに熱分解することでフッ素が逃げてしまったため,単離には至りませんでした.
あとに残ったのは穴だらけの白金でした.
フッ素ガスの単離に成功したのはFrémyの研究室にいたこともあるアンリ・モアッサン (Ferdinand Frédéric Henri Moissan, 1852-1907) です.

彼は高温ではフッ素が容器と反応してしまうため,低温で行う必要があるだろうと見当をつけていました.
フッ化水素酸に水が含まれていると水の電気分解で酸素が得られたり,フッ素が発生したとしても水と反応して酸素やオゾンが得られてしまうことがわかっていました.
そこで,まずはフッ化水素酸から水を取り除くことにしました.
Frémyはかつて,フッ化カリウムKFとフッ化水素酸HFを反応させてつくったKHF2を再結晶で精製し,これを熱分解して発生させたフッ化水素HFガスを濃縮することで無水フッ化水素酸をつくっていました.
そこでモアッサンは1886年,同様にして得られた無水フッ化水素酸を用いて氷点下で電気分解しました.
そうすると陽極からガスが十分量発生し,これを化学的な分析に用いることができました*10.
代表的なフッ素化合物として知られていたフッ化ケイ素SiF4は比較的安定な物質でしたから,モアッサンはフッ素とケイ素は激しく反応するはずだと考えていました.そこで陽極にたまったガスとケイ素を反応させたところ,炎をあげて爆発的に反応しました.
モアッサンは以上の結果から陽極に発生したのは未知の元素,フッ素(の単体)であるとしてアカデミーに報告しました.
アカデミーはこの発見を調べるようFrémyらに命令し,モアッサンは彼らの前で実験することになりました.
いざ同じ実験をしようとしたところ,今度はフッ素の気泡すらみせることができませんでした.一体どうしてでしょう?
モアッサンは以前うまくいったときの実験サンプルを確認しました.すると,純粋なはずの無水フッ化水素酸にたまたま,これを作るときに使ったKFが混じっていたことが発覚しました.このKFが無水フッ化水素酸の電気伝導度を上昇させていたのです.
このことに気づいたモアッサンは翌日,無事にFrémyたちの前でフッ素の単離を成功させてみせました.
Frémyは「自分の教え子が父親を乗り越え,自分より優っていくのを見ることは,常に師としての喜びである」という言葉を残しています.
その後,モアッサンは20世紀の初頭にかけてフッ化アルキルをはじめとした数多くのフッ素化合物を合成しました.これらの研究は1906年ノーベル化学賞の受賞につながりました*11.フッ化化合物の合成技術の発展により,フロンガスCCl2F2やテフロン,そしてウラン濃縮などへと応用されていきました.
4.フッ化水素の製造法
フッ化水素は蛍石から得るのが一般的です.蛍石と硫酸を100-300℃くらいに加熱しながら反応させます.
蛍石にはフッ化カルシウムの他にもシリカSiO2,炭酸カルシウムCaCO3,酸化鉄Fe2O3,酸化アルミニウムAl2O3,硫化鉄FeSなどが含まれています.
硫酸を反応させると,こうした不純物との反応も起きます.
また,鋼鉄製の容器を用いた場合は内壁と硫酸の反応も考えられます.
さらに,フッ化カルシウムとの反応で生じたHFが蛍石中のSiO2とも反応することも考慮しなければいけません.
したがって,ガスとしてはHFの他にSiF4,H2O,SO2,H2S,CO2などが発生することになります.
発生したガスを60-70℃に冷やすと,以下の反応で固体の硫黄Sが生じます.これで硫黄化合物は分離できます.
また,HFよりも重いH2Oや硫酸ミストなどは,重さの違いにより分離することができます.硫酸による洗浄や蒸留による精製により,きれいなHFが得られます.
一方,リン鉱石からリン酸H3PO4を得る際にもフッ化水素を得ることができます.
【参考】酸の歴史(8):リン酸
おおよそ30%ヘキサフルオロケイ酸H2SiF6が得られますが,これを加熱するとHFが得られます.
製造したフッ化水素ガス,もしくはフッ化水素酸は,腐食を防ぐためにフッ化鉄FeF3の層で保護した鋼鉄製の容器に保存されます.
濃度が50%以下のフッ化水素酸でしたら,完璧とは言わないものの プラスチックでも大丈夫です.厚みなどには十分注意しましょう.
かつてデービーをはじめとした研究者たちが苦しめられたように,フッ化水素酸は人体に対して深刻な損傷を与えます.親油性が高いため組織深部に到達し,損傷を与えるのが厄介な点です.
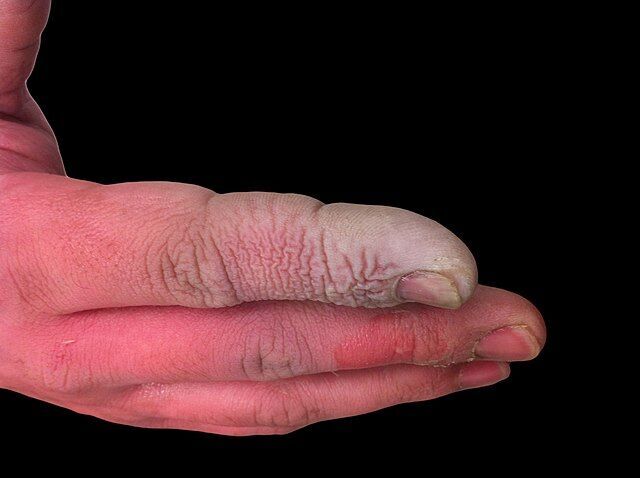
組織に浸透したフッ化物イオンF-は細胞死を引き起こすだけでなく,血中のカルシウムCa2+やMg2+といった陽イオンと結合し,低カルシウム血症や低マグネシウム血症を引き起こし,カルシウムとバランスされていたカリウム濃度の異常上昇により高カリウム血症を引き起こします.
結果として,組織の損傷に加え神経や血管の機能障害も引き起こし,重篤な症状を招いてしまいます.
こうしたフッ化水素酸の影響を軽減するには,水による希釈か,グルコン酸カルシウムが有効です.グルコン酸カルシウムはフッ化物イオンF-と不溶性の塩を形成してこれをトラップし,それ以上悪さをするのを防いでくれます.
フッ化水素酸はこのように非常に危険な物質ですので,扱いには十分気をつけなければいけません.化学工場での漏出などは,亀尾フッ化水素酸漏出事故など対処の難しい被害につながります.
【参考】亀尾フッ化水素酸漏出事故(wikipedia)
また,かつて日本国内ではフッ化ナトリウムNaFと間違えて児童の歯にフッ化水素酸を塗り死亡させた八王子市歯科医師フッ化水素酸誤塗布事故が発生しました.
【参考】八王子市歯科医師フッ化水素酸誤塗布事故(wikipedia)
当時,フッ素といえば医薬品業界ではフッ化水素酸を,歯科医師業界ではフッ化ナトリウムを指すという略語の違いも事件の背景にあったようです.
普段自分の使わない物質であったとしても,類似化合物の性質を知っておくことは重要ですね.
5.まとめ
危険なイメージの強いフッ化水素酸ですが,現代ではガラスの加工だけでなく,半導体の製造やフッ素化合物の原料にも使われる重要な物質です.
フッ化水素酸に限った話ではありませんが,物質の危険と向き合い,制御し,利用してきたのが化学の歴史の一側面とも言えるでしょう.
さて,9回に渡って酸の歴史をみてきましたが,いかがでしたでしょうか?ただの化合物にも意外な歴史が隠れていることを実感していただけたのではないかと思います.
今度教科書を見る際は,是非,「どんな歴史があるんだろう?」と調べてみてください.きっと面白い歴史が隠れているはずです.もしリクエストがございましたら,お気軽にフォームからご連絡ください.または@omizu_water3 や質問箱( https://peing.net/omizu_water3 )にご連絡頂いても構いません
参考文献
"ULLMANN'S Encyclopedia of Industrial Chemistry" Wiley-VCH Verlag GmbH & Co. KGaA (2002).
" Kirk-Othmer Encyclopedia of Chemical Technology" Wiley-VCH Verlag GmbH & Co. KGaA (2003).
"A History of Chemistry" J.R. Partington (1970-).
"Glas in der Frühen Neuzeit - Herstellung, Verwendung, Bedeutung, Analyse, Bewahrung" A.C. Cremer (2022).
"Effect of Fluorspar on silicate melts with special reference to mineral wool" J.S. Machin and J.F. Vanecek (1940)
"Observation concernant une volatilisation remarquable d’une partie de l’espece de pierre, à laquelle on donne les noms de Flosse, Flüsse, Flus-spaht, et aussi celui d’hesperosl laquelle volatilisation a été efectuéw au moyen des acides." A.S. Marggraf, Histoire de L'Académie Royale des Sciences et des Belles Lettres de Berlin avec les Mémoires pour la même année, tirez des registres de cette Académie, 24, 3-11 (1768 (1770)).
"The Chemical Works of Carl Wilhelm Scheele" A. Lennartson (2017).
"The chemical essays of Charles-William Scheele. Translated from the transactions of the Academy of Sciences at Stockholm, with additions" K.W. Scheele (1901).
"The history of fluorine -from discovery to commodity" J.Wisniak, Indian Journal of Chemical Technology, 9. 363-372. (2002).
"Some new experiments and observations on the substances produced in different chemical processes on fluor spar" Phil. Trans. 103, 263-279 (1813).
"Hydrofluoric Acid Burns" D.L. Schwerin, J.D. Hatcher (2023).
"The Lost Elements: The Periodic Table's Shadow Side" M. Fontani, et al (2014).
J. Flahaut & C. Viel, “Chapter 2: The Life and Scientific Work of Henri Moissan” Journal of Fluorine Chemistry, 33, 27–44 (1986).
『元素発見の歴史』M.E. Weeks, H.M. Leicester (2010).
『フッ化水素酸』井上嘉亀,化学教育, 16, 18-20 (1968).
『フッ素 ー推測と発見,単離をめぐる人々』丹波源男,日本歯科医史学会会誌,21, 41-46 (1995).
『ガラスの文明史』黒川高明 (2009).
『元素に名前をつけるなら』江頭和宏 (2022).
*1:なぜ赤色になるのかはNeriも知らなかったようです.後に,特定の大きさの金コロイド粒子は表面プラズモン共鳴により可視光を吸収し,溶液(やガラス)が赤色に見えるようになることがわかりました.
*2:通説では銅版画で使う硝酸によるエッチングから着想を得たとされていますが,シュヴァンハルトの技術は手順が大きく異なっていたので,ガラスを腐食する酸を作ろうという意図を持っていたわけではないと考えられています.銅版画では表面全体をロウなどで覆い,そこに模様をひっかき,酸を施すのですが,シュヴァンハルトはニスで図形を描き,残りの部分に酸を施していました.そうすることで,図柄がきれいに浮かび上がったのです.
*3:このときなんの酸を使ったかは記録は残っていませんが,おそらくパウリから製法を知ったWeygandは硝酸を用いたレシピを記録しています.ここではそれにならいました.のちにMarggrafはこの反応時に赤色の気体が発生することに触れていますので,おそらく硝酸カルシウムの熱分解も起きているのでしょう.
*4:鉛そのものは古代オリエントでガラス製造に使われていました.工業スケールでの鉛ガラスの製造は,ヴェネツィアンガラスの品質低下・納期遅れに悩まされて自前でガラス製品を作っていたGeorge Ravenscroft (1618–1681) が確立しました.
*5:ボヘミアのガラス職人がヴァルトグラスに使っていた質の悪い原料を精製して作ったガラスで,1683年以降市場に出回りました.石灰の量がバランスよくガラスに入らなかったようです.
*6:アンペールはデービーへの手紙で"fluore", "fluorure", "phtore"を提案していました."fluorure"は発音しづらいので難がありましたが,アンペールとしては残り2つのうち,ギリシャ語で"destroy, corrupt"などの意味がある"phtore"を推していたようです.物質の特性をよくあらわしていますからね.結局デービーは"fluore"を採用しました.
*7:デービー自身もフッ化水素酸については調べを進めていて,アンモニアと反応させても水を生じないことから酸素は含まれていないだろうということは突き止めていました.
*9:それで「すごい強力なボルタ電池」を使おうとしたわけです.
*10:モアッサンの妻も実験の様子が気になっていたようで,当日は幼い息子と一緒に夫の実験している建物の近くをうろうろしていました.モアッサンは実験に成功すると窓を開け,急いで駆け寄ってきた妻に「成功したよ」と嬉しそうに報告しました.