18世紀,鉛室法の登場によって硫酸が大量に製造されるようになり,漂白など様々な用途に使われました.
鉛室法とはどんな方法なのでしょうか?
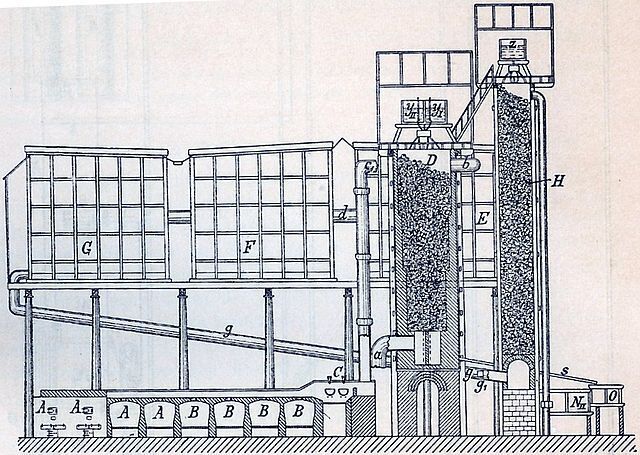
19世紀の化学工業を語る上で外せない,鉛室法のしくみと歴史を見てみましょう.
酸の歴史(1):酸とはなにか?
酸の歴史(2):錬金術と硫酸
酸の歴史(3):鉛室法の発明
酸の歴史(4):染料と接触法
酸の歴史(5):硝酸と硝石
酸の歴史(6):オストワルト法
酸の歴史(7):塩酸
酸の歴史(8):リン酸
酸の歴史(9):フッ化水素酸
1.ベル法

硫黄Sを燃やすと,二酸化硫黄SO2になります.
さらに酸化して三酸化硫黄SO3にすることができれば水に吸わせて硫酸H2SO4にすることができます.
しかしSO2の酸化はなかなかうまくいきませんでした.
結論から言えば,SO2の酸化には触媒が必要でした.

1651年,グラウバー (Johann Rudolf Glauber, 1604-1670) が硝石KNO3を少しいれて加熱すると,硫酸まで変換できることを発見しました.
メカニズムはよくわかっていませんが,おそらくKNO3の熱分解で生じたNOが空気中でNO2へと変換され,これがSO2の酸化を手伝っているのだと考えられます*1.
こうして合成した硫酸は,当時一般的に使われていた金属のほとんどを溶かしてしまいました.そのためこの液体を扱うには高価で壊れやすいガラス製の容器を用いる必要がありました.この容器はガラスベルと呼ばれたことから,ベル法とも呼ばれました.
17世紀末には,ベル法による工場がフランスやオランダに建設されました.1736年にはイギリスのTwickenhamに,ウォード(Joshua Ward, 1685-1761) が大きな工場を建設しました*2.約230 Lのガラスベルが使われたそうです.大きいですね!彼は1749年に特許も取得しました.
ウォードの工場は当時世界最大級の硫酸製造力を誇り,硫酸の価格は1トン3500ポンド*3から1トン220ポンドまで下がりました.
2.鉛室法の発明
さて,このようにベル法の登場により硫酸の価格は低下しましたが,ベル法は非常に壊れやすいガラスベルを使うという点が欠点でした.
Joseph Black (1728-1799) から化学を学んだイギリスのローバック(John Roebuck, 1718-1794) は,グラウバーの初期の資料を調べていたとき,硫酸が鉛を腐食しないという記述を発見しました.そこでローバックはガラスの代わりに鉛を反応容器に使うことを考えました.鉛室法の発明です.
ローバックはまず1746年,イギリス国内のバーミンガムの工場に鉛室法の設備を導入しました.しかし,先程のウォードはこれが彼のイギリス国内での特許を侵害していると主張しました.
そこでローバックはスコットランドに移り,1749年,エディンバラ郊外のPrestopansに硫酸製造工場を建設しました.ローバックの硫酸製造により,硫酸の科学は1トン41ポンドに下がりました."English vitriol"として売られた硫酸は,大陸中に知れ渡りました.
ちょうどこの頃,硫酸の使い道に変化が現れていました.

それまで,白い布の漂白には天日干しのほか,発酵させた牛乳による「酸洗い」が行われてきました.複数回行われる酸洗いは一回あたり5日程度かかり,漂白そのものには6-8ヶ月かかっていました.
【参考】洗濯(9):白くみせる,増白
スコットランドでは,発酵させた牛乳のかわりに希硫酸を用いると酸洗いにかかる時間が5時間程度に圧縮されることが発見されました*4.漂白期間はトータルで4ヶ月くらいになりました.
このように,それまであまり使い道のなかった硫酸の需要が一気に高まりました*5.硫酸は良く売れるようになり,大きな富を得ることができました..
ローバックは硫酸製造法を秘密にしておきたかったようですが,あまりにアイデアがシンプルだったので,秘密を隠し通すには不向きでした.ゴムの加硫と似ていますね.
【参考】ヘリウム(1):風船に使うのはなぜ?
鉛室法の工場は徐々に増え,1820年にはイギリスで23の工場が稼働し,一時は1トン17ポンド (1806年)にまで下がりました.1815年のイギリスでの硫酸製造量は2700トンに達したとのことです.フランスへは1760年代にイギリス人John Holkerによって製法がもたらされ,ボヘミア,ドイツ,アメリカ,カナダなどに普及していきました.
ちなみに,鉛は硫酸に溶けにくいとはいっても完全に耐性があるわけではありません.そこでアメリカにはじめて硫酸工場を設立したJohn Harrison (1773-1833) は鉛よりもさらに耐性のある白金に着目しました.
白金の加工は比較的難しかったそうですが,ちょうどWilliam Hyde Wollaston (1766-1828) が白金の加工技術を開発したところでした.
そこでWollastonの知り合いのErick Bolmanとともに,1813年,Harrisonは白金製容器を用いた蒸留によって高濃度の硫酸を製造する手法を確立しました.これにより,78%くらいまで濃縮することができました.
このように19世紀には世界各地に鉛室法の硫酸工場が建設されました.
3.鉛室法のしくみ
鉛室法は発明以後,排ガスを効率よく再利用する改良が進められました.

革命戦争中,硝石が不足していたフランスでは研究が進んでいました.1842年にはゲイ=リュサック (Joseph Louis Gay-Lussac, 1778-1850)が鉛室で発生した窒素酸化物を回収するゲイ=リュサック塔を実用化しました.しかし当時は回収したあと,窒素酸化物を分離する手法がなかったため導入は進みませんでした.
一方イギリスでは1859年にJohn Glover (1817-1902)が硫酸と硝酸を分離するグローバー塔を開発しました*6.これなら窒素酸化物を効率よく回収することができます.
1868-1870年ころにチリ硝石の輸入量が一時的に激減して価格が高騰したことにより,窒素酸化物の回収が重要視されると,ゲイ=リュサック塔,およびグローバー塔を組み合わせた改良版の鉛室法が世界中に普及しました.

鉛室法は廃れた技術ですが,窒素酸化物NOxと硫黄酸化物SOxの反応のしくみは大気汚染の分野で研究が進んでいますので,それらを参考に鉛室法のしくみを再構築してみましょう.
STEP 1.SO2の発生
まずは焙焼炉です.ここではSO2を発生させます.
原料として主に用いられたのは硫黄,もしくは黄鉄鉱です*7*8.

もともとはシチリア産の硫黄が用いられました.しかしながら1830年代,イギリスとフランスの間で硫黄をめぐる奪い合い(硫黄戦争)が発生すると供給が不安定化しました.
【参考】黒色火薬の歴史(3):硫黄
シチリア国王が硫黄の輸出をフランス企業に独占させた1838年以降,イギリスでは硫黄の調達が困難になり,隣国アイルランドの黄鉄鉱*9が使われるようになりました.
1880年代にクラウス法が登場すると,ルブラン法で廃棄されていた硫化カルシウムCaSから硫黄が生成されるようになり,イギリス産の硫黄も使われるようになりました.
一方アメリカでは,1890年にヘルマン・フラッシュ (Hermann Frasch, 1851-1914) が地下の硫黄を直接回収するフラッシュ法を確立しました.第一次世界大戦中に外国産黄鉄鉱の輸入が滞ると,アメリカではこちらの硫黄も使われるようになりました.
硫黄の原料はこのように多角化していったのですが,原料によっては不純物が問題となります.特に原料として黄鉄鉱を用いた場合,ヒ素As*10やセレンSeが混じっていることがあります.
これらは硫化水素H2Sによって除去します.
H2Sを用いると,鉄Fe以外のほとんどの不純物 (Pb, Sb, Cu含む) が除去されますので便利ですね.
STEP 2. 窒素酸化物の発生
次はSO2を酸化するステップです.この反応を促進するのには,窒素酸化物が使われます.まずは窒素酸化物を発生させましょう.

窒素酸化物はチリ硝石NaNO3から発生させるのが一般的でした*11.
チリ硝石にはいくつかグレードがありました.グレードの低いものはNaClを多く含む場合があったのですが,硫酸と反応させると塩酸HClが発生してしまいます.
塩酸は鉛室にダメージを与える可能性があるのではないかと考えられていたので,なるべくNaCl含有量の低いものが好まれました.
STEP 3.硫酸の合成
さて,次は鉛室です.ここでは窒素酸化物によってSO2を硫酸H2SO4に変換します.
生じたNOはゲイ=リュサック塔で回収します.こうすることで,ロスをへらすことができます.
結果.トータルでは以下のようになります.
ちなみに鉛室では水蒸気の供給が重要です.水蒸気が足りないと,下のような反応が進行し,NOHSO4の白い結晶(chamber crystal)が析出するからです.
そのため,鉛室での水蒸気量の管理が重要です.水蒸気が十分にあれば,分解して硫酸を生成します.
STEP 4.窒素酸化物の回収
発生したNOやNO2を濃硫酸 (78%以上) に吸収させるとNOHSO4というちょっと変わった分子になります.これが実は重要です.
ゲイ=リュサック塔では,窒素化合物が逃げてしまわないように硫酸に吸収させてNOHSO4に変換します*12.
グローバー塔の外見はゲイ=リュサック塔と似ていますが,機能はその逆です.ゲイ=リュサック塔では硫酸に窒素酸化物を吸わせていましたが,グローバー塔ではそこから窒素酸化物と硫酸を分離します.
グローバー塔の内部は耐火レンガで充填されており,上からNOHSO4を注入して下降させ,下から400℃くらいのSO2を吹き入れ上昇させ,レンガのところで反応させます.
生じた硫酸H2SO4は下降しつつ加熱,濃縮され,再びゲイ=リュサック塔に戻されます.ちなみにグローバー塔で生じる硫酸は,全体で合成されるものの約25%といわれています.
はじめはグローバー塔から得られる硫酸は有機化合物などの不純物により茶色く着色していました.コークスによりこれを除去する工程が追加されたことで得られる硫酸は水のように透明になり,工場労働者からはお酒のジンのようだと言われました.
反応で生じたNO,未反応のSO2,そして水蒸気は冷却されつつ再び鉛室に移動します.
以上が鉛室法のしくみです.実際にはもっと複雑に接続されていますが,原理は同じです.
さて,このように生じた硫酸にはどうしても少量の窒素化合物が混じっています.例えばこのような硫酸を石油の精製に使用すると,石油が黄色に着色してしまいます.
窒素化合物の除去には,例えば硫酸アンモニウム(NH4)2SO4を使用することができます.
また,原料に含まれるAsやSeを硫化水素H2Sによって除去する場合,窒素酸化物も同時に除去されます.
鉛室法は,日本では明治5年 (1872年),大阪の造幣局にイギリスのRoland Finchを招いて鉛室が一組導入されました.一日に5トン生産できたようです.その後,1880年には硫酸製造会社(のちの大阪アルカリ株式会社)が川口に,1885年には大蔵省印刷局が東京府王子村に鉛室法を導入しました.
4.まとめ
鉛室法の登場によって,硫酸は化学工業の主役に成り上がりました.
次回はそんな硫酸のさらなる活用法を支えた接触法について見てみましょう.
参考文献
"ULLMANN'S Encyclopedia of Industrial Chemistry" Wiley-VCH Verlag GmbH & Co. KGaA (2002).
"History of Analytical Chemistry" F. Szabadváry, Pergamon press (1966).
"Sulfur History, Technology, Applications & Industry" Gerald Kutney (2013).
"The Clouds of Venus: Sulfuric Acid by the Lead Chamber Process" G.T. Sill, Icarus 53, 10-17 (1983).
"Sulphuric Acid" W. Wyld (1924).
”Sulphuric Acid and Alkali" G. Lunge (1913).
"Chamber Process Manufacture of Sulfuric Acid" E.M. Jones, Ind. Eng. Chem. 42, 2208-2210 (1950).
"Unraveling a New Chemical Mechanism of Missing Sulfate Formation in Aerosol Haze: Gaseous NO2 with Aqueous HSO3–/SO32–" J, Yang, et al., JACS 141, 19312-19320 (2019).
"Nitrogen Capture" A.S. Travis (2018).
"A History of Industrial Chemistry" F.S. Taylor (1957).
"The Alkali Industry" J.R. Partington (1919).
"The 1900 arsenic poisoning epidemic" P. Dyer, Brewery History, 130, 65-85 (2009).
“The origins and early development of the heavy chemical industry in France” J.G. Smith, (1979).
L. Gittins, “Innovations in Textile Bleaching in Britain in the Eighteenth Century” Business History Review, 53, 194–204 (1974).
『硫酸』井上嘉亀,化学教育, 16, 10-15 (1968).
『酸,アルカリ及肥料 上巻』庄司務 (1936).
『基本酸・アルカリ・肥料 補6版』本間久松 (1951).
『無機工業化学通論』小栗捨蔵 (1947).
*1:ここでは水分子の関与を無視しています.水滴中での反応についてはいくつか反応機構が提示されています.
*2:Twickenhamでは近隣住民から苦情が出たため,工場は1740年にRichmondに移転しました.
*3:もっとも,1トン単位では売れませんでした.
*4:塩素漂白の登場は,18世紀末のことです.
*5:後には,漂白用の塩素製造に必要な塩酸を合成する際にも使われるようになりました.
*6:特許を取得せず,自身の開発したグローバー塔を周囲の人たちにも教えてあげたことで,近隣に普及しました.
*7:ちなみにドイツやベルギーでは亜鉛製錬が盛んで,硫化亜鉛ZnSから作る場合もありました.後にアメリカでも採用されたようです.
*8:このほか,石炭ガスを酸化鉄で洗浄した時に生じるSpent-oxideも使われました.
*9:19-20世紀初頭において世界最大産地はスペインで,年間200万トン,世界シェアの約40%を占めていました.
*10:19世紀末イギリスでは,硫酸はビールの原料となる糖をデンプンやてんさい糖から作る際に使用されました.その際,未精製の硫酸が使われたため,1900年に未曾有のヒ素中毒事件を引き起こしました.
*11:この他,窒素酸化物の発生にはアンモニアの酸化反応を利用することもできます.
*12:ちなみにNO2はN2O4とも平衡状態にあり,当時はこれを問題視する説がありました.N2O4も硫酸に吸収されなくはないのですが効率は低いので,SO2を吹き込んで一部をNOに還元させる必要があるというものです.