酸とはなんでしょう?酸っぱい物質でしょうか?それとも水素イオンを放出する物質でしょうか?
「酸とはなにか?」という疑問は化学者が長い間取り組んできた問題でもあります.

酸の定義の変遷については今後触れる機会があると思いますので,今回は酸の性質や指示薬,pHなど,ちょっと違った角度から酸の歴史を見ていきたいとおもいます.
酸の歴史(1):酸とはなにか?
酸の歴史(2):錬金術と硫酸
酸の歴史(3):鉛室法の発明
酸の歴史(4):染料と接触法
酸の歴史(5):硝酸と硝石
酸の歴史(6):オストワルト法
酸の歴史(7):塩酸
酸の歴史(8):リン酸
酸の歴史(9):フッ化水素酸
1.酸とはなにか?
そもそも,酸とはなんでしょうか?

もともとは,食品などに含まれる酸っぱい液体のことを酸と呼んでいました.レモンに含まれるクエン酸や,お酢に含まれる酢酸といった有機化合物の酸などです.
教科書にまず出てくる塩酸や硫酸,硝酸といった無機化合物の酸,いわゆる鉱酸 (mineral acid) が登場するのは,蒸留技術が向上した錬金術の時代です.私は舐めたことはありませんが,うすい塩酸や硫酸は,確かに酸っぱい味がするようです.
このような酸に分類される分子は,水中で水素イオンH+を放出します*1.水素イオンH+は舌表面に存在する受容体タンパク質*2によって認識され,酸味を伝えることがわかっています.そのため,酸を「水中で水素イオンH+を放出するもの」として定義するならば,酸はたしかに酸っぱいのです*3.
ただ,酸っぱさと酸の定義にするにはちょっと頼りなさそうです.毎回舐めるわけにはいきませんし,酸味の感じ方は人や状況によって変化しますからね.
「酸っぱさのもと」がなにか特定の物質だろうという考え方は,古代ギリシャにも登場します.例えばプラトン (Plátōn, 前427-前347)は,酸味のもとである酸は発酵によって精製された物質であり,発泡を引き起こすと考えていました.
当時ギリシャでは柑橘類は知られていませんでしたから,酸は発酵によって得られた酢(酢酸)がメインでした.
発泡との関わりに触れているのは,おそらく酢を石灰などのかけらにかけると発泡する様子をみたことがあったからかもしれません.
ボイル (Robert Boyle, 1621-1691) の時代にも,酸の特徴として,味のほかにアルカリ(炭酸塩)と反応させると発泡を起こすことが挙げられていました.
しかしもちろん,すべてのアルカリと発泡現象を示すわけではありません.
ほかにも,希硫酸H2SO4は亜鉛Znなどの金属と反応させると水素の泡が発生します.
しかしながら,銅Cuとは反応しません.
一方,希硝酸HNO3は銅と反応し,泡が発生します.しかしこの場合は水素ガスではなく一酸化窒素NOが発生します.
濃硝酸HNO3の場合は二酸化窒素NO2が発生します.
発泡現象はアルカリと反応する酸の性質というよりは,それぞれ個別の反応といったほうが良さそうです.
現在では,酸は味や発泡性ではなく,H+の放出,もしくはより一般的に電子対の受容といった形で定義されています.前者はおなじみですね.後者は大学化学で習うものです.とはいえ,わかりやすさを考慮すると,場面に応じて使い分けるのが得策のように思います.
2.指示薬

酸については味や発泡の他に,色を変化させる能力も着目されていました.
例えば紫キャベツの煮汁は酢を足すと赤色に,重曹を足すと青色になりますね.
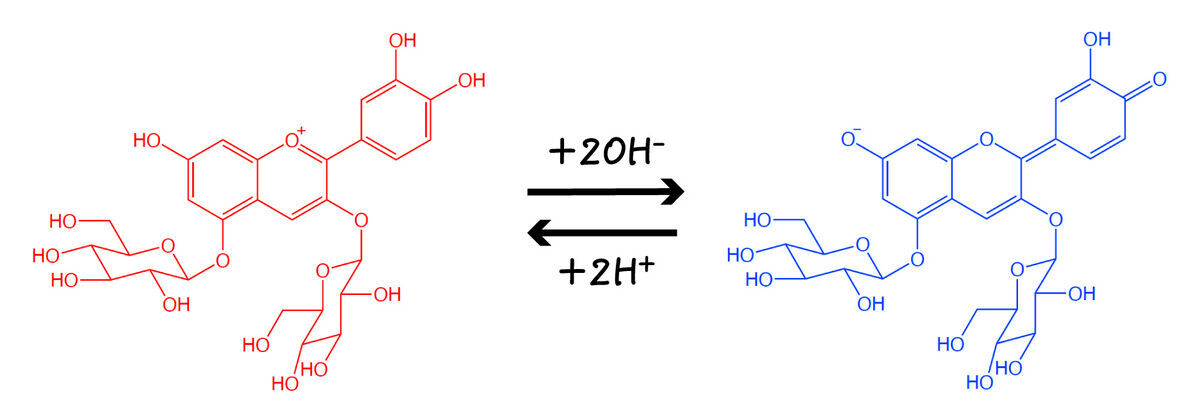
これは紫キャベツの煮汁に含まれるアントシアニンがpHによって構造変化し,吸収する光の波長が変わるためです.
紫キャベツの抽出液がpHを調べるのに都合が良いことは,冬場に使える植物を探していたワット(James Watt, 1736-1819)が1784年に示しています*4.一方で植物抽出液をpHを調べるのに使うというアイデアそのものは,それよりもっと以前からありました.
例えばスイスのLeonard Thurneysser (1531-1596) は,硫酸がスミレの抽出液を赤く変化させることを示しました*5.スミレにもアントシアニンが含まれています.

ボイルも酸がいろんな植物抽出液の色を変えることを報告しています.例えばヤグルマギク,コチニール,ヘリオトロープ*6,ウコンなどです.
ボイルが報告した植物抽出液のうち,面白いのはLignum nephriticumです.

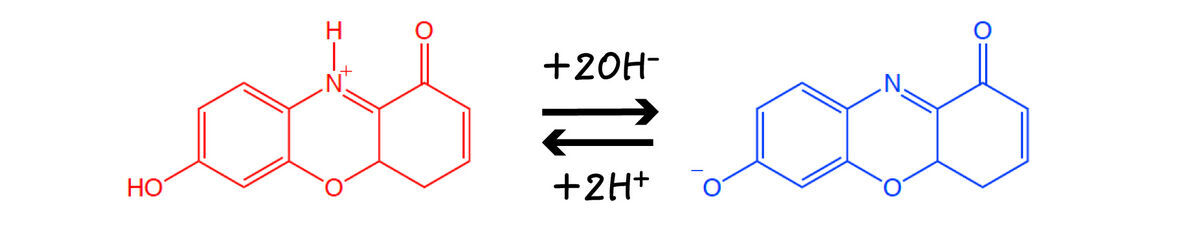
大航海時代にメキシコからもたらされた珍しい木の抽出液Lignum nephriticum*7は青白い蛍光を発し,腎臓の病を治す神秘的な液体として珍重されました.その木から作ったコップは,水を入れておくとLignum nephriticumが得られるので大変有難がられ,王侯貴族への贈り物として使用されました.
1663年,ボイルはこの貴重な液体*8が酸により蛍光を失い,アルカリによる中和で蛍光を回復することを発見しました.世界初の蛍光pH指示薬といっても良いかもしれません.Lignum nephriticumそのものは余りにも希少であったため,やがて歴史から姿を消しました.
ボイルはまた,今で言うpH試験紙のようなものも使用していたようです.白い紙にスミレの抽出液を少し落とし,ここに2, 3滴,酢などのサンプルを落として色の変化を観察しました.こうすることで,抽出液そのものの色の変化を見ようとするより少量のサンプルで済んだようです.

リトマスゴケの抽出物,リトマスもまた,酸の検出に使われました*9.リトマスは青〜紫色をしており,紙の染色などに使われていました.
「青い紙」の文化は古くは少なくとも14世紀の中東でみられ,アラビアでは公式の便箋として,ペルシャでは薬を包むのに使われました.アヤメの花をはじめとした植物抽出液やラピスラズリで染められていたようです.
ヨーロッパでも,ヴェネツィアを中心に14世紀末には使われるようになりました.青い紙は高品質な白い紙よりも安いということ*10で,デッサン用の紙や,安価な出版物の表紙,砂糖の包装紙などに使われました.染料としてはインジゴのほか,ブルーベリーの抽出液,そしてリトマスも使われました.特にリトマスで染められた青い紙はオランダで製造されたものが有名でした.
砂糖の包装紙として使われたリトマス紙は身近にありましたので,これを使ってみようという発想はごく自然なものだったと考えられます.18世紀末にはWilliam Lewis (1767年)やBergman (1775年) が実際にリトマス紙を酸の検出に使っています.William Lewisは,抽出液の色変化を中和滴定にも利用しました.
酸の検出にはスミレやリトマスなど様々な植物抽出液が使われましたが,それぞれ特徴がありました.
例えば1775年,イタリアの博学者Felice Fontana (1730-1805) は,炭酸水はリトマスの抽出液は赤に変えるけれども,スミレの抽出液は色が変わらないことを記録しています.
これはつまり,抽出液中の色素はそれぞれ反応するpHの範囲(変色域)が異なることを意味しています.こうした抽出液の反応性の違いを活用し,酸の強弱の比較も行われました.
このように植物抽出液は酸の検出に非常に便利だったのですが,いくつか問題がありました.例えば保存しておくとバクテリアに分解されたり,塩濃度が高かったり酸が弱かったりするとうまく色の変化が出なかったのです.
そこで1870年代,様々な化合物が酸の検出に使えないか試されました.pHにより色が変化する化合物は,指示薬 (indicator) *11と呼ばれました.
1875年,Weiskeはサリチル酸を用いることを提案しました.サリチル酸は塩化鉄FeCl3を加えると呈色しますが,酸を加えると色がうすくなります.これは合成化合物をpH指示薬に用いた初の事例です.
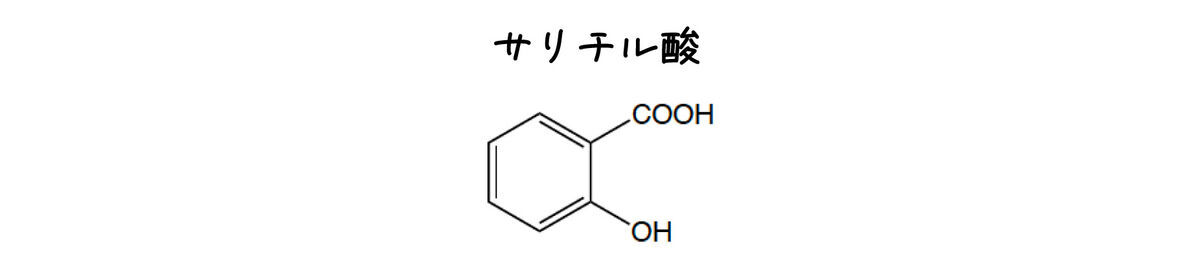
あまり色の変化はシャープではなかったようですが,サリチル酸を用いた研究を皮切りに合成化合物をpH指示薬として使うブームがやってきました.
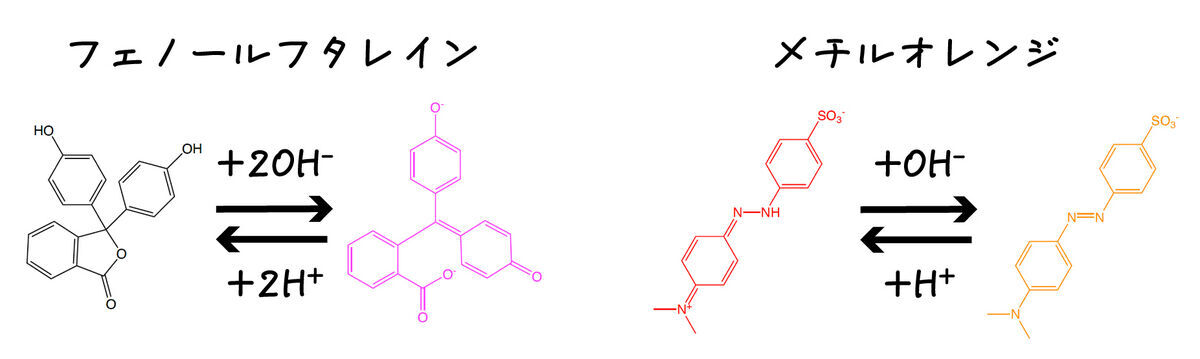
1877年にはフェノールフタレインが,1878年にはメチルオレンジが指示薬として使われました.これらは非常にわかりやすい色の変化だったため,広く使われるようになりました.今でも使われていますね.
フェノールフタレインとメチルオレンジは色が変わるpHの範囲が異なるため,組み合わせて使うとより効果的です.フェノールフタレインは大体pH 8-10で,メチルオレンジは大体pH3-4で変色します.
これにより,例えば炭酸ナトリウムNa2CO3と水酸化ナトリウムNaOHの混合溶液について,それぞれの濃度を求めることができるようになりました.
【参考】滴定の歴史(2):中和滴定と水素イオン濃度
フェノールフタレインやメチルオレンジのように,どのpHで色が変化するかは指示薬によって異なります.このことをかなり厳密に調べたのがFriedenthalで,1904年,水素イオン濃度が1×10-1から1×10-14Mまでの14種類*12と2種類の強酸性溶液*13と1種類の強アルカリ性溶液*14の合計17種類の水溶液を調整し,14種類の指示薬についてそれぞれの色変化を細かく調べました.
原理的には,Friedenthalのように指示薬をたくさん組み合わせれば,水素イオン濃度 (pH) を推定することが可能です.しかしながらやはりこれは大変ですね.次に見るように,水素イオン濃度はやがて電位測定によって計測されるようになりました.
4.pH
酸性,アルカリ性などは水素イオン濃度を指標として判定されますね.中性ならば付近で,これより水素イオンが多ければ酸性,少なければアルカリ性です.
ただし水素イオン濃度は通常1 mol/Lよりかなり小さく,その変動幅はかなり大きいので毎回そのまま表現するのは大変です.そこで普段は水素イオン濃度*15の指数に着目し,pHとして表現します.
ならば,
です.

pHは1909年,デンマークの化学者セーレンセン(Søren Peter Lauritz Sørensen, 1868-1939) によって導入されました.pHで着目する指数は英語でpower,もしくはドイツ語ではpotenzです.そこで水素 (H) の指数 (powerもしくはpotenz) ということで"pH"と名付けられました.
pHはおおよそ1910年代に定着したといわれています.はじめは,彼が実際に使ったpH・やPhなどの表記もありましたが,pHという表記が科学雑誌Journal of Biological Chemistryに公式に採用されたこともあり,これが普及しました*16.
セーレンセンがpHを導入した経緯をちょっとだけ紹介しましょう.
セーレンセンはもともと酵素の研究をしていました.酵素溶液に酸を少しずつ加えていくと酵素活性があるところでMAXになり,そして下がっていくという様子が観察されたのですが,酸によってMAXにするのに必要な量が違いました.
【参考】洗濯(6):酵素パワー
加えた酸の量ではなく水溶液中の水素イオン濃度を正確に測定する必要性に思い至ったセーレンセンは,水素濃度を正確に測定する水素電極,そしてpHの概念を導入しました.
生化学でよく出てくる水素イオン濃度は1 mol/Lより小さかったため,対数にマイナスをつけたというわけです.
セーレンセンはまた,pHを正確に調整した溶液も数多く作りました.そのうち,KH2PO4とNa2HPO4からリン酸緩衝液*17を作る方法は,現代の生化学にも取り入れられています.こうした緩衝液はpHが変化しづらく,酵素が働いてなにか物質を産生しても,それによるpHの変化が少ないという特徴があります.
当時生化学において酸性度を調べるには指示薬がよく使われていました.彼は約100種類のpH指示薬の色変化を各種溶液中で観察してその特徴を細かく調べ上げました.その結果,よく使われているコンゴ・レッドは分解されたタンパク質があるとうまく働かないことなどを指摘しました.
セーレンセンは様々な水溶液サンプルを用意し,pHを測定し,そして各種溶液中でペプシンやインベルターゼ,カタラーゼの酵素活性を測定しました.彼はこうした実験を通し,酵素研究における水素イオン濃度を正確に測定する重要性,そして酵素のはたらきによってpHが変わらないように緩衝液を用いる必要性を示しました.
こうしてセーレンセンによって導入されたpHは,はじめは一部の生化学者や酵素研究者によって使われました.実用性に優れているということでミカエリス-メンテンの式でも有名なミカエリス(Leonor Michaelis, 1875-1949) も使っており,1914年に出版されベストセラーになった『水素イオン濃度 (Die Wasserstoffionkonzentration)』でも紹介されました.
もちろんpHの定義に欠点がなかったわけではありません.当時の化学者が指摘しているように,「水素イオン濃度が増加するとpHが減少する」というのは増減が逆の対応関係にあり,わかりづらいですからね.とはいえ,やがてpHは化学者にも普及し,酸・アルカリとpHは切っても切り離せない関係になりました.
5.まとめ
「酸」とはもともと直感的な性質であったところから,化学の成熟とともに定義が改良されていき,現在の教科書にみられるような定義になりました.その背景には中和滴定のような実験技術の発展も見落とすことはできません.
こうした試行錯誤の歴史の背景には,日常的な概念を化学の文脈に落とし込んでいきたいという化学者の潜在的な欲求が潜んでいるのでしょう.
次回からは硫酸の歴史を見てみましょう.
参考文献
"ULLMANN'S Encyclopedia of Industrial Chemistry" Wiley-VCH Verlag GmbH & Co. KGaA (2002).
"Acidity: Modes of characterization and quantification" K. Ruthenberg, Studies in History and Philosophy of Science, 65-66. 121-131 (2017).
"Acidity: The Persistence of the Everyday in the Scientific" H. Chang, Philosophy of Science, 79, 690-700 (2022).
"The roles of two extracellular loops in proton sensing and permeation in human Otop1 proton channel" B. Li, et al. Communication Biology 5, 1110 (2022).
"A History of Indicators" A.A. Baker, Jr., Chymia, 9, 147-167 (1964).
"History of Analytical Chemistry" F. Szabadváry, Pergamon press (1966).
"The historical manufacture of blue-coloured paper" I. Brückle (1993).
"Analytical Chemistry" F.P. Treadwell, W.T. Hall, (1904).
"Ask the Historian" W.B. Jensen (2012).
"Uber die Messung und die Bedeutung der Wasserstoffionen- konzentration bei enzymatischen Prozessen" S.P.L. Sörensen, Biochemische Zeitschrift, 21, 131-304 (1909).
"Die Wirkung der Wasserstoffionen auf das Invertin." L. Michaelis, H. Davidsohn, Biochemische Zeitschrift, 35, 386-412 (1911).
"On a New Method of Preparing a Test Liquor to Shew the Presence of Acids and Alkalies in Chemical Mixtures. By Mr. James Watt, Engineer; Communicated by Sir Joseph Banks, Bart. P. R. S." J.Banks and J. Watt, Philosophical Transactions of the Royal Society of London, 74, 419-422 (1784).
"Anthocyanins in Brassicaceae: composition, stability, bioavailability, and potential health benefits" N. Zhang & P. Jing, Critical Reviews in Food Science and Nutrition, 62, 2205-2220 (2022).
"Blue flower color development by anthocyanins: from chemical structure to cell physiology" K. Yoshida, et al. Natural Product Reports, 26, 884-915 (2009).
"Lignum Nephriticum" W.E. Safford, Annual report of the Board of Regents of the Smithsonian Institution, 271-298 (1916).
"Die Bestimmung der Reaktion einer Flüssigkeit mit Hilfe von Indikatoren" H. Friedenthal, Zeitschrift für Elektrochemie und angewandte physikalische Chemie, 10, 113-119 (1904).
『生理活性植物因子アントシアニンの色と構造』中川裕子ほか,J. Jpn. Soc. Colour Mater. 79, 113-119 (2006)
『フェノール類の塩化鉄(III)試験における酸による呈色の妨害』長谷川正,臼井豊和,化学と教育,40, 780-782 (1992).
*1:アレニウスは酸性溶液中ではH+のほうがOH-よりも多く,そのようにH+を過剰にさせる物質を酸性としました.
*2:Otop 1と考えられています.細胞外に位置するヒスチジン残基がH+を認識します.Otop 1は活性化されると細胞内へH+を流入させる穴を開き,シグナルを伝えるという説が2022年10月,発表されました.
*3:酸っぱいものが全て酸かというと,それはまた違う話です.
*4:ワットはモミジアオイやスミレ,アヤメなど春〜夏に咲く花の抽出液で染めた紙を用いていましたが,冬になると使えなくなってしまうこともしばしばでした.
*5:ちなみにアルカリ性の場合,スミレ汁は緑色に変化します.また,彼が調べた亜硫酸H2SO3はスミレ汁を漂白しました.
*6:ボイルはリトマスと書いていますが,違うのではないかという説があります.
*7:後にこの抽出液は二種類の木が混同されたもので,腎臓の病を治す液体はメキシコ原産のキドニーウッドEysenhardtia polystachyaである一方,ヨーロッパで有名になったコップはマニラ・アカプルコ間のガレオン貿易によりフィリピンのナラ材から削り出されたものだと特定されました.
*8:メキシコ原産の木から得た方のようです.
*9:1300年頃Arnau de Vilanova (1235-1313) が用いたとする説がありますが,酸の検出として使用したかは判断を保留しておきます.
*10:他にも,中東での使い方がおしゃれだったので憧れた,色彩表現上興味深かった,ということもあるようです.
*11:1873年,Eugen Schaalが天然色素であるアリザリンをpH変化の検出に利用した際に"指示薬(indicator)"という語が使われました.
*12:1×10-1から1×10-4Mは塩酸,1×10-5と1×10-6Mは塩酸とホウ酸,1×10-5と1×10-6Mは水酸化カリウムとアニリン,1×10-10から1×10-14Mは水酸化カリウムで調製しました.1×10-7Mについては水やリン酸緩衝液など8種類示しています.
*13:HClです.
*15:正確には活量です.
*16:みんなすんなりと受け入れたかというとそうではありませんでした.水素イオン濃度が多ければ酸性ですが,pHは小さければ酸性ですから逆の対応関係でわかりづらいですからね.しかしやはり便利だったようで,1920年代にはpHを用いて酸性・アルカリ性を表現するのが一般的になりました.
*17:リン酸一水素塩とリン酸二水素塩から緩衝液を作る方法自体は1903年にPál Szilyが確立していました.緩衝液そのものは,1900年のビール加工学会で,麦芽抽出液がpH緩衝能を持つことをFernbachが報告していました.彼は抽出液中のリン酸一水素塩とリン酸二水素塩が,「荷馬車の緩衝用円盤(buffer disk)のように作用し,酸と塩基の作用を弱める」と説明しました.これが,緩衝液(buffer)という名称の由来です.