滴定を行う上では,中和反応がどこまで進行したかをモニターし続けることが大事です.
有名なのは紫キャベツの煮汁やリトマス試験紙の色変化ですが,他にはどんな方法が活用されてきたのでしょうか?

今回はpHメーター開発以前のモニター方法について,原理とともに見ていきましょう.
滴定の歴史(1):中和滴定の誕生
滴定の歴史(2):中和滴定と水素イオン濃度
滴定の歴史(3):電極によるpH測定
滴定の歴史(4):酸化還元滴定の発明
滴定の歴史(5):ヨウ素滴定の開発
滴定の歴史(6):ヨウ素滴定の発展
滴定の歴史(7):過マンガン酸塩滴定
滴定の歴史(8):酸化還元指示薬
滴定の歴史(9):沈殿滴定
1.合成指示薬

前回紹介したように,初期の中和滴定では,指示薬としてスミレやリトマスなど様々な植物抽出液が使われました.
【参考】滴定の歴史(1):中和滴定の誕生
しかしながら,こうした植物抽出液にはいくつか問題がありました.例えば保存しておくとバクテリアに分解されたり,塩濃度が高かったり酸が弱かったりするとうまく色の変化が出なかったのです.
そこで1870年代,様々な化合物が酸の検出に使えないか試されました.pHにより色が変化する化合物は,指示薬 (indicator) *1と呼ばれました.
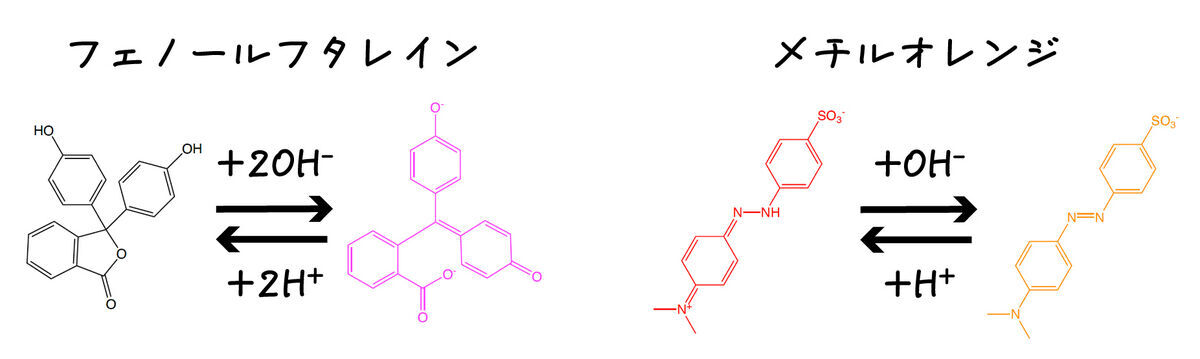
こうして開発された指示薬のうち,有名なものはフェノールフタレイン (1877年)やメチルオレンジ (1878年)でしょう.メチルレッド (1908年)もよく使われました.
これらは色が変化するpH領域(変色域)が異なるため,組み合わせて使うと効果的です.例えばフェノールフタレインは大体pH 8-10で,メチルオレンジは大体pH3-4で変色します.
炭酸ナトリウムNa2CO3と水酸化ナトリウムNaOHの混合溶液について,それぞれの濃度を求めることを考えてみましょう.

塩酸HClを加えていくとまず1段階目の中和反応が進行し,
さらに加えると2段階目の中和反応が進行します.
1段階目に必要なHClの量をV1, 2段階目に必要なHClの量をV2とすると,炭酸ナトリウムNa2CO3の量はV2から,水酸化ナトリウムNaOHの量はV1-V2から求めることができます.
1881年にアメリカの化学者ワルダー (Robert Bowne Warder, 1848-1905)の報告した方法*2では,pH指示薬としてフェノールフタレインのみを使っていました.しかしフェノールフタレインの変色では第1段階目しか検出できません.
ここで溶液中のHCO3-のようすをみてみましょう.HCO3-は溶液中のCO2と平衡状態にあります.
そこでワルダーは1段階目が終わった段階で溶液を加熱してCO2を追い出しました.するとpHが上昇します.
結果,フェノールフタレインが赤色の領域までpHが戻ってきます.ここに酸を加えて反応させましょう.
そうすると再び中和によりpHが減少し,フェノールフタレインが無色に戻ります.このようにして,フェノールフタレインの変色域で中和反応を再び検出することができます.
しかし,これでは面倒臭いですね.そこでのちにFriedrich Wilhelm Küster (1861-1917) などが1897年に提案したように,変色域の異なるメチルオレンジも用いた方が良さそうだと考えられるようになりました.
メチルオレンジの変色域はpH 3-4付近ですので,2段階目の中和反応で色が変わります.そのため,メチルオレンジの変色までに加えた酸はV1+V2となります.フェノールフタレインの変色までに加えた酸はV1ですので,差を取ればV2も求められますね.
こうして確立した手法は,ワルダー法と呼ばれるようになりました.
ちなみに,塩化バリウムBaCl2を加えて炭酸イオンCO32-を沈澱させてからNaOHのみを定量する方法もあります.
酸を静かに加えれば,NaOHだけを反応させることができますので,よりシンプルです.中和反応の完了はフェノールフタレインで判定し,先程のメチルオレンジの結果と比較します.

こちらはドイツの化学者ヴィンクラー (Clemens Winkler, 1838-1904)*3の名を取って,ウィンクラー法*4と呼ばれます.
このように指示薬の性質をうまく利用することで,中和滴定によりNa2CO3とNaOHの量を求めることができました.このような滴定は分別滴定とも呼ばれます.
工業的にもこうした合成指示薬は活用されました.例えば硬水の軟水化ではアルカリを加える際のpH制御が重要でしたが,1906年に開発されたシステムではフェノールフタレインの色変化でpHをモニタリングしました.
【参考】浄水(7):化学の力で軟水にする
2.中和滴定と水素イオン濃度
こうした指示薬の色変化のしくみは,1891年,オストワルト*5の著書『Lehrbuch der Allgemeinen Chemie』で説明されました.

オストワルトは指示薬が弱酸または弱塩基であると考えました.簡単のため弱酸の場合に限って説明すると,指示薬は以下の平衡にあると考えることができます.
弱酸の強さは,酸解離定数を導入することで比較可能です.
このとき,HAが赤色で,A-が黄色だったとしましょう.酸性のときは大部分がHAで赤色ですが,アルカリが加えられると中和してA-に変化して,黄色に変化します.これはメチルオレンジの色変化に対応します.
オストワルトの見方では,指示薬によってどの程度強い酸か,もしくは強い塩基かが異なるため,メチルオレンジとフェノールフタレインのような変色域の違いが生まれるというわけです.
現在では事情はもう少し複雑であることがわかっていますが*6,水素イオン濃度と色変化の対応について明快な説明を与えた説でした.
指示薬の色変化が水素イオン濃度と関係するという指摘を受け,Hans Wilhelm Friedenthal (1870-1943) は1904年に,水素イオン濃度が1×10-1から1×10-14Mまでの14種類*7と2種類の強酸性溶液*8と1種類の強アルカリ性溶液*9の合計17種類の水溶液を調整し,14種類の指示薬についてそれぞれの色変化を細かく調べました.
興味深いことに,Friedenthalは酸性の溶液だけでなく,アルカリ性の溶液についても水酸化物イオンOH-ではなく水素イオンH+の濃度で表示しました.これは当時すでに水のイオン積が1×10-14付近であることが知られており,ここから逆算すれば水酸化物イオン濃度が計算できたからです.
これにより,酸性・アルカリ性を水素イオン濃度という統一的な尺度で表現することができました.
Eduard Salmはさらに多く,55種類もの指示薬を調べ,指示薬の酸解離定数を測定しました.そして指示薬の酸解離定数は,指示薬の50%が解離しているときの水素イオン濃度に等しいことを指摘しました.
これは50%解離しているとき,[HA]=[A-]ですので,確かに酸解離定数と水素イオン濃度が等しくなりますね.
[HA]=[A-]という状況はまた,指示薬の色が変化するポイントでもあります.
Salmは以上の研究から,弱塩基と強酸の中和反応など,中和点 ( [H+]= 10-7となる点) と当量点が異なる場合には,当量点での水素イオン濃度付近で指示薬が色変化する,すなわち酸解離定数が当量点での水素イオン濃度に近いものを選ぶ必要があると指摘しました.
これが先程のメチルオレンジとフェノールフタレインの使い分けにつながりました.
こうした水素イオン濃度をしょっちゅう指数で表すのは大変でしたので,やがて1909年に生化学者のセーレンセンが提案したように,水素イオン濃度をpHで表すようになりました.
【参考】酸の歴史(1):酸とはなにか?
3.水素イオン濃度の測定
ところで水素イオン濃度,もしくは「酸の強さ」はどのように測定されていたのでしょうか?
よく使われていたのは,エステルの加水分解 ,ショ糖の転化といった化学反応*10や,電気伝導度や電位差といった電気的な性質です.
エステルやショ糖は酸によって加水分解されますが,その加水分解の速度は酸濃度,より正確には水素イオン濃度に依存します.
エステルとして酢酸メチルを考えましょう.酢酸メチルCH3COOCH3の加水分解では,以下のように正反応と逆反応が考えられます.
酢酸メチルCH3COOCH3が減少する速度は以下のように表されるはずです.
伝統的には,水が大過剰の場合は逆反応を無視します.これは,化学平衡が右に大きく傾くためと説明されます.
触媒である水素イオンは反応によって消費されないので反応中は一定とみなせます.そこで色んな条件で反応速度を調べれば,水素イオン濃度を逆算できるという算段です.
反応速度を調べるには酢酸メチルに酸を加え,一定時間ごとに決まった量の反応溶液を取り出して水で10倍くらいに薄めて反応を実質的にストップさせ,フェノールフタレインなどを指示薬としてアルカリで速やかに滴定します.
しかしながらエステルの加水分解では,そもそも逆反応が本当に無視できるのか,酸を加えたことによる溶解熱はどうなのか,といった複数の要因を考慮する必要があり,正確な測定は難しそうです.
ショ糖の加水分解はどうでしょうか?
ショ糖が加水分解されてD-フルクトースとD-グルコースが生成されると,旋光度が変化します.これはショ糖の旋光度が+66.5°であったのに対し,D-フルクトースが-92.4°,D-グルコースが+52.2°のためです.

結果として溶液は右旋性から左旋性 (-92.4° + 52.2° = -40.2°)に変化するので,ショ糖の加水分解は転化とも呼ばれます.1850年,Wilhelmyによって明らかにされました.
旋光度を測定していれば加水分解の速度がわかるので,加水分解速度に影響を与える水素イオン濃度も計算できるというわけです.
滴定の必要なエステルの加水分解よりもショ糖の転化のほうが実験系としてはシンプルですが,それでもリアルタイムに滴定の様子を観察するのには不向きです.
滴定のリアルタイム測定に絶大な力を発揮したのは電気的な測定です.
例えば電流を測ると,算出した抵抗の値から電気の通しやすさ(電気伝導率)を調べられます.
水溶液中では,イオンが移動することで電流が流れます.中でもH+は水分子間をバケツリレーのように素早く移動するため,他の陽イオンに比べて1 mol/m3あたりの電気伝導率が高いです.
こうしたイオンによる電気伝導率の違いについては1875年にドイツの物理学者コールラウシュ (Friedrich Wilhelm Georg Kohlrausch, 1840-1910) が詳しく調べました.

1903年にはFriedrich Wilhelm Küster (1861-1917)らが電気伝導率の測定をNaOHとHClの中和滴定*11に応用しました.
例えばHClをNaOH水溶液で中和滴定することを考えてみましょう.中和点に近づくにつれNa+よりも電気を通しやすいH+が減るので電気伝導率が低下します.

一方で当量点を超えると加えたNa+,OH-の分だけ電気伝導率が上昇します.結果として当量点で電気伝導率が最小になります.
弱酸を使う場合は様子が異なりますが,原理は同じです.塩による電気伝導率の変化(salt-line)を考えるとわかりやすいです.

弱塩基を用いる場合は,当量点のあとはほぼsalt-lineに重なります.
まとめるとこんな感じになります.

4.まとめ
電気伝導率はこのように当量点を決定する目的には使用できますが,水素イオン濃度そのものの変化を見ているわけではありません.
水素イオン濃度の変化をモニタリングするには,次回見るように,電流ではなく電圧を測定する必要がありました.
参考文献
"ULLMANN'S Encyclopedia of Industrial Chemistry" Wiley-VCH Verlag GmbH & Co. KGaA (2002).
"History of Analytical Chemistry" F. Szabadváry, Pergamon press (1966).
"Sur l'emploi des soudes dans les fabriques à savon de Marseille" M. Laurens, Annales de chimie, 67, 97-106 (1808).
"Origin of Standard Solutions"F. Sabadváry, Chemist and Druggist, 168, 616 (1957).
"Dosage du carbonate de chaux." M. Bineau, Journal de pharmacie et de chimie. 12, 301-303 (1847).
"XIX. Alkalimetry with Phenol Phthalein as Indicator" R.B. Warder, American chemical journal 3, 55-58 (1881).
"Kritische Studien zur volumetrischen Bestimmung von karbonathaltigen Alkalilaugen und von Alkalikarbonaten, sowie über das Verhalten von Phenolphtaleïn und Methylorange als Indikatoren" F.W. Küster, Zeitschrift für anorganische Chemie, 13, 1-448 (1897).
"Die Bestimmung der Reaktion einer Flüssigkeit mit Hilfe von Indikatoren" H. Friedenthal, Zeitschrift für Elektrochemie und angewandte physikalische Chemie, 10, 113-119 (1904).
"Studie über Indikatoren" E. Salm, Zeitschrift für Physikalische Chemie, 57, 471-501 (1907).
“An Optical Chiral Sensor Based on Weak Measurement for the Real-Time Monitoring of Sucrose Hydrolysis” D. Li, et al. Sensors, 21, 1003 (2021).
"Intermediate Chemistry" T.M. Lowry and A.C. Cavell (1939).
"A history of indicators" A. Albert Baker, Jr., Chymia, 9, 147-167 (1964).
"Über die Festlegung des Neutralisationspunktes durch Leitfähigkeitsmessung” F.W. Küster, M. Grüters, Zeitschrift für anorganische Chemie, 35, 454-459 (1903).
『ハリス分析化学』D.C. Harris, 化学同人 (2017).
『分析化学の歴史』F. Szabadváry (1988).
"物理化学実験「酢酸エステルの加水分解速度測定」の問題点と改良法" 永井俊, 日本医科大学基礎科学紀要, 44, 1-24 (2015).
*1:1873年,Eugen Schaalが天然色素であるアリザリンをpH変化の検出に利用した際に"指示薬(indicator)"という語が使われました.
*2:酸としてシュウ酸を用いていました.
*4:溶存酸素の測定法・開発者とは異なります.また,ドイツ語の発音的にはヴィンクラー法と呼んだほうが良い気もします.
*5:硝酸製造法であるオストワルト法で有名な,オストワルトです.
*6:例えばA. Hantzschは1899年に互変異性によるモデルを示し,WhiteとAereeは1915年にフェノールフタレインの発色メカニズムについてキノン-フェノール酸塩 (quinone-phenolate salt) の寄与を指摘しました.さらなる理論の精緻化には,共鳴理論の発展を待つ必要がありました.
*7:1×10-1から1×10-4Mは塩酸,1×10-5と1×10-6Mは塩酸とホウ酸,1×10-5と1×10-6Mは水酸化カリウムとアニリン,1×10-10から1×10-14Mは水酸化カリウムで調製しました.1×10-7Mについては水やリン酸緩衝液など8種類示しています.
*8:HClです.
*10:ほかに,アルカリ性であればけん化なども利用されました.J. Shieldsによって1893年に示されました.
*11:NaOH水溶液をHClで滴定するものです.