過マンガン酸カリウム溶液やヨウ素溶液のように色がはっきり変化する場合は良いですが,色が変化しない酸化還元反応はどうすれば良いでしょうか?

今回は酸化還元滴定の幅を広げた,酸化還元指示薬の歴史をみてみましょう.
滴定の歴史(1):中和滴定の誕生
滴定の歴史(2):中和滴定と水素イオン濃度
滴定の歴史(3):電極によるpH測定
滴定の歴史(4):酸化還元滴定の発明
滴定の歴史(5):ヨウ素滴定の開発
滴定の歴史(6):ヨウ素滴定の発展
滴定の歴史(7):過マンガン酸塩滴定
滴定の歴史(8):酸化還元指示薬
滴定の歴史(9):沈殿滴定
1.酸化還元滴定のしくみ
中和滴定のときは滴定量(体積)に対して,溶液のpHをプロットすると変化がわかりやすかったです.酸化還元滴定ではどうでしょうか?
酸化還元滴定では,溶液の電位の変化をモニターしているとわかりやすいです.当量点付近で電位がぐぐっと変化しているのがわかります.
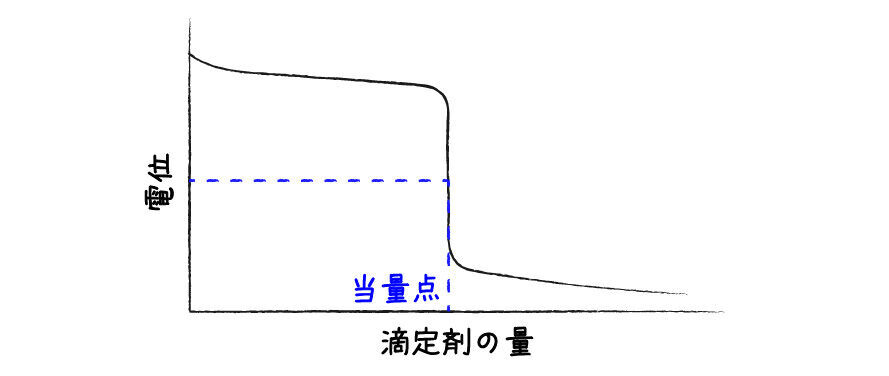
電位を測るのが難しくても,酸化還元反応で溶液の色が変化する場合は,色を直接見ていれば滴定の終点を判断することができます.
例えば過マンガン酸塩滴定では,濃い青紫色の過マンガン酸カリウムKMnO4が強酸性中で無色のMn2+に還元されます.

一方,ヨウ素滴定ではあらかじめデンプンを加えておくと,過剰のI3-がデンプンのらせん構造に入り込み,青紫色に呈色します*1.
この他にも溶液の色変化があるものとしては塩化鉄FeCl3の溶液があります.塩化鉄FeCl3の水溶液は黄褐色ですが,塩化スズSnCl2により還元されると淡緑色のFeCl2水溶液に変化します.

この色変化は滴定時は大変見づらいため,ガスバーナーの青い炎を用いることを提案する人もいました.溶液ごしに炎の色をみると,はじめは溶液が黄褐色のため炎が緑色に見えていたのが,FeCl2に変化すると炎の色が青色にみえるようになる,とのことです.使いやすさは不明ですが,夜にも実験できる!と著者は主張しています.
このように,うまいこと溶液の色変化があればよいのですが,そうでない場合は一工夫必要です.
そこで有効なのが,特定の電位範囲で酸化・還元される際に色が変化する化合物を利用する方法です.そのような指示薬は酸化還元指示薬と呼ばれます.
細かい理論的な部分は割愛しますが,酸化還元滴定の最中,溶液の電位をじっとみていると,中和滴定におけるpHのように電位が当量点付近で大きく変化します.
中和滴定のときは,このようにpHがジャンプする領域で色が変化する物質をpH指示薬として利用し,滴定の終点を決定するのでした.
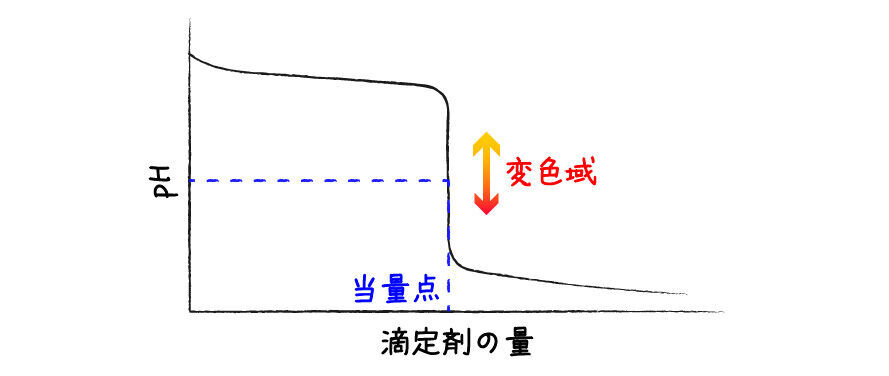
同様に,酸化還元滴定でも電位がジャンプする領域で色が変化する物質*2を指示薬として使うのが良さそうです.
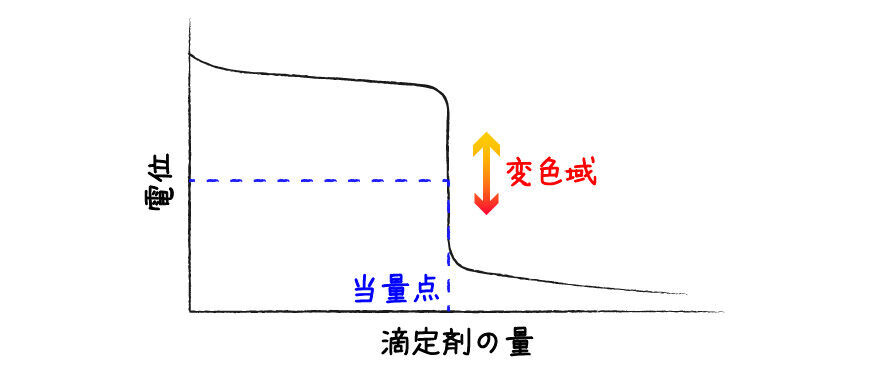
指示薬によって応答する電位範囲が異なるので,酸化還元反応に応じて適切な酸化還元指示薬を選択すれば,溶液そのものの色変化がなくても指示薬の色変化で終点を決定することができます.
このように,酸化還元滴定では電位を直接測定するか,反応溶液の色変化,もしくは適切な酸化還元指示薬の使用によって終点を判断することができ,酸化還元滴定による物質の定量が可能になります.
2.外部指示薬と酸化還元滴定
中和滴定と違い,酸化還元滴定に使える指示薬はなかなか開発されませんでした.
はじめに使われたのはインジゴでしたが,その色変化は酸濃度によって影響を受けるためあまり正確ではありませんでした.
溶液中に入れるタイプの指示薬は良いものがしばらくなかったので,その代わりに溶液を少し取り出し,外部で指示薬と反応させる斑点法が用いられました.このように外部で使う指示薬は外部指示薬と呼ばれました.
例えばフランスのPenotは,漂白液を亜ヒ酸の溶液で滴定する際,インジゴだと色の変化がわかりにくいなあと悩んでいました.
そこで1852年,ヨウ素と水酸化ナトリウム,片栗粉を煮た溶液に浸した紙を用いて終点を判定することにしました.
ヨウ素と水酸化ナトリウムを反応させるとヨウ化ナトリウムNaIが生成します.
ヨウ化ナトリウムは漂白液によって酸化され,ヨウ素に変化します.
するとヨウ素I2とヨウ化物イオンI-からI3-が生成し*3,
これが片栗粉に含まれるデンプンのらせん構造に入り込み,青紫色に呈色します.
したがって,作成した紙,いわば「ヨウ化ナトリウムデンプン紙」の色変化は,酸化剤の検出に使えるというわけです*4.
Penotは漂白液を亜ヒ酸ナトリウム溶液で滴定する際,漂白液がまだ漂白力を保持しているかどうかをヨウ化ナトリウムデンプン紙で確認しました.
漂白液が亜ヒ酸ナトリウム溶液と完全に反応すると漂白力,つまり酸化力が失われますのでヨウ化ナトリウムデンプン紙の色変化がなくなります.ここで滴定終了です.
ここでPenotが亜ヒ酸H3AsO3ではなく亜ヒ酸ナトリウム溶液Na3AsO3を用いている点に注意しましょう.1814年にヨウ素デンプン反応を報告したM.M.Colin, Henri-François Gaultier de Claubry (1792-1878)らが記録しているように,塩酸などの酸はヨウ素デンプン反応の色味を赤く変化させてしまうことがあります*5.そこで,色変化への影響が少ない亜ヒ酸ナトリウム溶液Na3AsO3を用いているというわけです*6.
やがて,紙の染め方が改良され,ヨウ化カリウムを用いたヨウ化カリウムデンプン紙が広く使われるようになりました.
一方,染料工場のオーナーだったWalter Crum (1796-1867) は1840年代,別の外部指示薬を用いて軟マンガン鉱に含まれる二酸化マンガンMnO2の含有量を測定する法を考案しました.
彼は二酸化マンガンの含有量を調べるため,塩酸と反応させたときに塩素が発生する反応と,塩素と硫酸鉄(II)の酸化還元反応を利用しました.
この反応においては,Crumは外部指示薬としてヘキサシアノ鉄(III)酸カリウムK3[Fe(CN)6]の溶液で染めた紙を用いました.

K3[Fe(CN)6]は赤血塩ともよばれる赤色の固体で,微量のFe2+と反応してプルシアンブルーとも呼ばれる水溶性の鮮やかな青色の物質*7に変化します.
反応溶液を少しとってK3[Fe(CN)6]で染めた紙にたらします.Fe2+が塩素ガスCl2によってすべてFe3+に酸化されている間は紙に色の変化はありませんが,FeSO4が過剰になるとKFe[Fe(CN)6]が生成され,青色に変化します.
K3[Fe(CN)6]で染めた紙の色変化を指標に軟マンガン鉱が反応しなくなるまで塩酸を加え,消費した硫酸鉄水溶液の量を定量しました.
K3[Fe(CN)6]による鉄の検出は,クロム酸塩滴定でも用いられました.
スコットランドの化学者Frederick Penny (1816-1869) はミョウバン頁岩からミョウバンを製造する際の原料について調査したところ,こうした鉱石中の鉄を定量するのは既存の方法では非常に煩雑であることが判明しました.そこで1850年,クロム酸塩溶液による滴定法を報告しました.

操作はシンプルで,鉱石を塩酸で溶かし,二クロム酸カリウムK2Cr2O7溶液で滴定しました*8.
滴定中は反応溶液を少し取り,K3[Fe(CN)6]の溶液に加えて青色に変化するかどうかでFe2+の存在を確認しました.
Fe2+が消費され,青色に変化しなくなった時点で滴定終了です.
これが初のクロム酸塩滴定です.クロム酸塩滴定は様々な鉄鉱石に用いることができました.
ドイツの化学者Jakob Schabus (1825-1867) も同様の方法を考案しています.彼の場合は,鉄を溶かした溶液中に含まれるFe3+を事前に亜鉛でFe2+に還元しておくステップへの言及があります.
このような操作を予備還元と言いますが,亜鉛を用いると亜硫酸ナトリウムを用いる場合よりも迅速に還元できたようです.
Schabusはまず第一にクロム酸塩の入手が容易で,純度も保ちやすく,溶液が安定であることを利点にあげています.また,この方法が非常に簡便だとして,貿易業者も使用することを勧めています.
このように,過マンガン酸塩滴定やヨウ素滴定のような溶液の色変化がない場合でも,ヨウ素やK3[Fe(CN)6]で染めた紙や溶液を外部指示薬として使用することで終点を判断することができました.しかしこうした外部指示薬は限られた反応にしか使えませんでした.
3.内部指示薬と酸化還元滴定

19世紀末ごろになると,インジゴ以外の内部指示薬も用いられるようになりました.例えばフランスのM. G. Linossierは水中の溶存酸素を滴定する際にフェノサフラニンを使用しました.
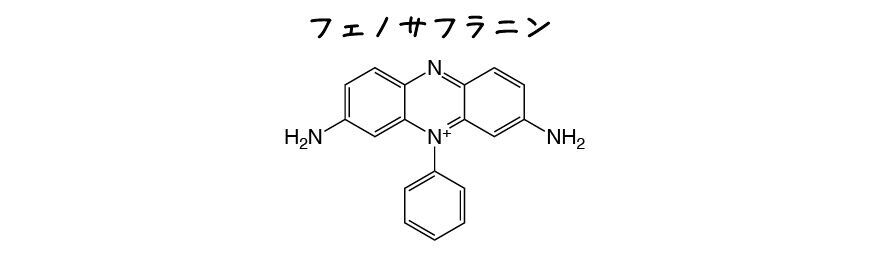
まず水に水酸化ナトリウムNaOH,酒石酸カリウムナトリウム*9 KNaC4H4O6・4H2Oを溶かし,フェノサフラニンを溶かしたアルコール溶液を1, 2適加えます.溶存する酸素の影響でフェノサフラニンはピンク色の酸化体に変化します.
ここに硫酸鉄水溶液を滴下します.すると溶存酸素によってFe2+がFe3+に酸化されます.
溶液はアルカリ性なので通常はFe3+が水酸化鉄を生成して沈殿してしまいますが,溶液中の酒石酸がFe3+と錯体をつくり,沈殿をつくるのを不正でいます.
こうして滴下に伴い溶存酸素が消費されていき,酸素が完全になくなるとフェノサフランは無色の還元体に変化し,溶液のピンク色が消失します.フェノサフラニンは溶液中で働く指示薬なので,内部指示薬ですね.
この方法はWinkler法と比べ,炭酸塩を多く含む水でも用いることができるのが利点でした.1914年にJames Millerによって改良され,日本やカナダで水質調査に用いられるようになりました.
しかしながら,フェノサフラニンは万能というわけではありませんでした.フェノサフラニンが使える酸化還元反応は限られていましたし*10,フェノサフラニンは終点で無色になりますが,指示薬としてはできれば終点で無色から有色に変わったほうがわかりやすいですね.
内部指示薬の使用が広く普及したきっかけはクロム酸塩滴定です.
クロム酸塩滴定のほとんどは過マンガン酸塩滴定に置き換えられていましたが,クロム酸塩滴定にも利点はありました.それは溶液の安定性が高いこと,そして鉱石中の有機物に反応しないことです.そのため,クロム酸塩の指示薬が探し求められていました.
1906年,L. Brandtはジフェニルカルボヒドラジド*11をFe2+を定量するクロム酸塩滴定に用いました.再現実験を行ったBarnebyとWilsonは彼の実験を再現できませんでしたが,ジフェニルカルバジド*12であればBrandtの言うような変化が生じることを示しました.
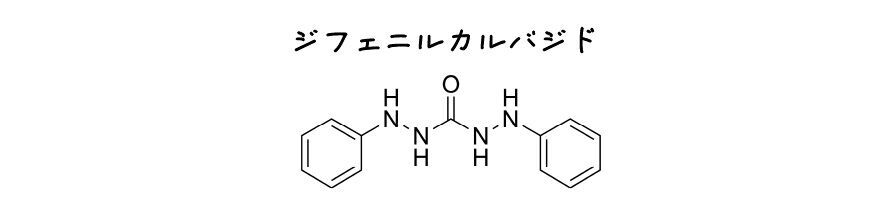
ジフェニルカルバジドは最初はピンク色ですが,だんだん深い赤色になり,最終的にはラベンダー色になったあとに終点付近で色が消失し,Cr3+の緑色が現れました.
しかしジフェニルカルバジドの色変化は実験条件や調製条件*13に依存してしまううえ,インジゴなどと同様に色変化は不可逆だったため,あまり使い勝手の良いものではなかったようです.
使い勝手の良い酸化還元指示薬は1924年,チェコの化学者J. Knopによって報告されました.彼はFe2+を定量するクロム酸塩滴定においてジフェニルアミンを用いました.
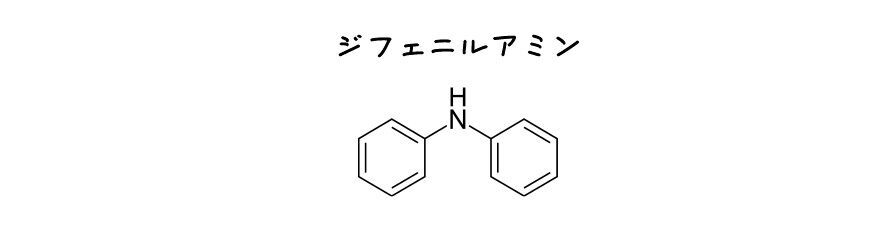
ジフェニルアミンは最初は無色ですが,滴定が進みクロム酸が過剰になると酸化体に変化し,青紫色になりました.
ジフェニルアミンの良かった点は,これが無色から有色に変化する点です.見た目にもわかりやすいですからね.ヨウ素滴定におけるヨウ素デンプン反応を思い出していただけると良いかと思います.
また,色変化が可逆であった点もメリットでした.例えばFe2+で還元してもとに戻すことができました.これは酸化還元反応による非可逆的な脱色を基本とするインジゴとは大きな違いです.
ジフェニルアミンは様々な酸化還元反応に用いることができました.例えば,1928年にはWillardとYoungがセリウム滴定*14に実際に使用しました.
ジフェニルアミンをきっかけとして酸化還元滴定に使える指示薬が次々に報告され,今まで溶液の色が変わらず日の目を見なかった滴定法が一気に活用されるようになりました.
5.まとめ
酸化還元滴定も指示薬が登場したことで応用の幅がかなり広がりました.中和滴定同様,電位差測定技術が確立してからはより正確に滴定できるようになりました.
次は沈殿滴定の歴史を見てみましょう.
参考文献
"History of Analytical Chemistry" F. Szabadváry, Pergamon press (1966).
"Ask the Histoiran" W.B. Jensen, Oesper Collections (2012).
"Ueber Alkalimetrie und Chlorometrie" Dr. Ure, Polytechnischen Journals, 96, 32-46 (1845).
"Sun un nouveau moyen de titrer le chlorure de chaux" Dr Penot. Bulletin de la Société industrielle de Mulhouse, 118, 246-253 (1852).
"Sur les combinaisons de l'iode avec les substances végétales et animales", M.M. Colin and H. Gaultier de Claubry, Annales de chimie, 90, 87-100 (1814).
"On the Origin of the Blue Color in The Iodine/Iodide/Starch Supramolecular Complex" S. Pesek, et al. Molecules, 27, 8974 (2022).
"Nouveau procédé de dosage de l'oxygène dissous dans l'eau" M.G. Linossie, Bulletin de la Société chimique de Paris, 5, 63-66 (1891).
"Ueber einige new Cerverbindungen" L. Th. Lange, Journal für Praktische Chemie, 82, 129-147 (1861)
"The balancing of oxidation-reduction equations. II" E.R. Jette, Journal of Chemical Education, 5, 1158-1167 (1927).
“New indicators in the reduction of ferric chloride by stannous chloride” F. H. Morgan, Journal of Analytical Chemistry, 2, 169-174 (1888).
J. Ellis, S. Kanamori, “An evaluation of the Miller method for dissolved oxygen analysis,” Limnology and Oceanography, 18, 1002-1005 (1973)
Schabus “Ueber die Anwendung des zweifach chromsauren Kalis zur Eisen-, Braunstein- und Chlorkalk-Probe,” Sitzungsberichte der Akademie der Wissenschaften mathematisch-naturwissenschaftliche Klasse, 6, 396-409 (1851).
O. L. Barnebey and S. R. Wilson “The application of diphenylcarbazide as indicator in the titration of iron with dichromate,” Journal of the American Chemical Society, 35, 156-162 (1913).
J. Knop “Diphenylamine as indicator in the titration of iron with dichromate solution,” Journal of the American Chemical Society, 46, 263-269 (1924).
L. Brandt , “Über die Anwendung von Diphenylkarbohydrazid als Indikator bei der Eisentitration nach der Bichromatmethode,” Zeitschrift für analytische Chemie, 46, 95-99 (1906).
A. Albert Baker, Jr., "A history of indicators" Chymia, 9, 147-167 (1964).
"ヨウ素デンプン反応の安定性" 小山彰, 新潟県立教育センター研究報告, 53, 55-62 (1982).
Sidney Skinner and S. Ruhemann, "The action of phenylhydrazine on urea and some of its derivatives" Journal of the Chemical Society, Transactions, 53, 550-558 (1888).
P. F. Urone, “Stability of Colorimetric Reagent for Chromium, s-Diphenylcarbazide, in Various Solvents,” Analytical Chemistry, 27, 1354-1355 (1955).
『ハリス分析化学』D.C. Harris, 化学同人 (2017).
『分析化学の歴史』F. Szabadváry (1988).
*1:ヨウ素デンプン反応については1814年にean Jacques Colin (1784-1865)とHenri-François Gaultier de Claubry (1792-1878)らが報告しています.植物や動物由来の物質に対してヨウ素がどのように作用するか?を調べる過程で発見されました.デンプンが多いと赤色になるけれども,適切な割合であればきれいな青色になることが記されています.また,塩酸などの酸が色味を赤く変化させることも指摘しています.
*2:1920年,W. M. Clarkが酸化還元電位とインジゴをはじめとした指示薬の色変化の関係を詳細に調べました.
*3:実際にはI82-やI6-, I9-とかかもしれませんが,そのへんは割愛しましょう.
*4:具体的には,酸の検出に使うリトマス紙みたいな使い方をイメージしてもらうとわかりやすいかと思います.
*5:おそらくデンプンとの複合体形成の平衡が移動するためと考えられます.
*6:ちなみにアルカリ性にしすぎてもだめです.ヨウ素が反応してしまいますからね.
*7:この他に不溶性の青色の固体もあり,こちらが一般的なプルシアンブルーFe4[Fe(CN)6]3です.
*9:フランスではPierre Seignette, 1660-1719)がつくった薬として知られ,セニエット塩とも呼ばれました.
*10:色変化が比較的低い電位で生じます.
*11:1900年にP. Cazeneuveがクロム酸や様々な金属塩の検出に使えるのではないかという論文を報告しています.
*12:1888年,SkinnerとRuhemannはジフェニルカルバジドは硫酸銅や塩化水銀により酸化されて色変化すると報告しています.
*13:ストック溶液がすぐに劣化してしまう問題は,1955年,P.F. Uroneによって解決されました.
*14:セリウム滴定の場合,Ce4+溶液の酸化力が強いことは1861年にLangeが指摘しており,鉄の定量などに使えるのではないかとさまざまな滴定法が考案されていましたが,適切な指示薬がなく,滴定が完了したかダイレクトに見る方法がありませんでした.