化学工業が発展した18世紀以降,酸やアルカリの量を知ることは原材料の品質を調べるうえで非常に重要でした.中でも中和反応を利用する中和滴定は未熟練者でも使える画期的な方法でした.
理科実験でお馴染みの中和滴定は,どのように誕生したのでしょうか?

今回は水質調査や硝石産業などと関わりに深い中和滴定の成立過程の歴史を見てみましょう.
滴定の歴史(1):中和滴定の誕生
滴定の歴史(2):中和滴定と水素イオン濃度
滴定の歴史(3):電極によるpH測定
滴定の歴史(4):酸化還元滴定の発明
滴定の歴史(5):ヨウ素滴定の開発
滴定の歴史(6):ヨウ素滴定の発展
滴定の歴史(7):過マンガン酸塩滴定
滴定の歴史(8):酸化還元指示薬
滴定の歴史(9):沈殿滴定
1.中和滴定とは?
酸の濃度を調べる方法として,中和滴定が知られています.
濃度のわかっているアルカリ性の溶液を徐々に加え,中和されたらストップし,そこまでに加えたアルカリ性溶液の量を調べるというものです.
このように,反応が終わるまでに試薬溶液,つまり滴定剤 (titrant) をサンプルに少しずつ加え,必要な滴定剤の量から物質の量を調べる方法を滴定といいます.ここでは,中和反応を用いているので,特に中和滴定と呼ばれます.
もともと,滴定の語源として使われたフランス語の"titre"という単語は,貴金属の純度を意味していました.例えば「満足できるtitreの硝石」とは,「純粋な硝石」を意味していました.それが沈殿滴定における滴定剤の消費量という意味で使われ,やがて現在の意味になったようです.
19世紀には,反応の終了に必要な物質の量を測定するすべての分析法が滴定法と呼ばれていました.現在では溶液の体積を調べるものだけが主に滴定と呼ばれていますが,それは天秤を使わない容積分析の方が簡便で,広く普及したからでしょう.
このように,滴定法は対象物の純度を調べる方法で,それは化学工業の発展とともに洗練されていった分析技術でした.
中和滴定の様子をつかむには,滴定剤(酸やアルカリ)の滴下量*1に対してpHをプロットした滴定曲線を描くとわかりやすいです.
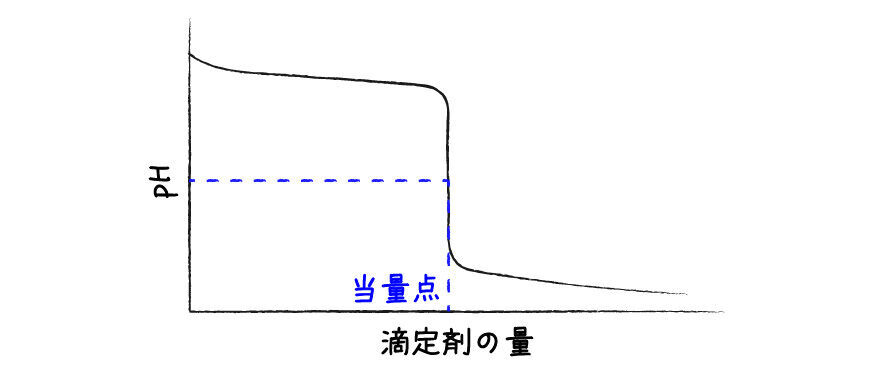
グラフが急に曲がっているポイントがありますね.ここは反応式から予想される,ちょうど中和する量の滴定剤が加えられた点です.このような点を当量点と呼びます.H2SO4 1 molをNaOHで中和するのであれば,NaOHを2 mol加えた点です.
この当量点こそが,中和滴定で求めたいものです.当量点さえ分かれば,反応式から逆算して元の酸やアルカリの濃度を推測することができます.
当量点を求めるには,pHの変化を何らかの方法で測定していれば良さそうです.
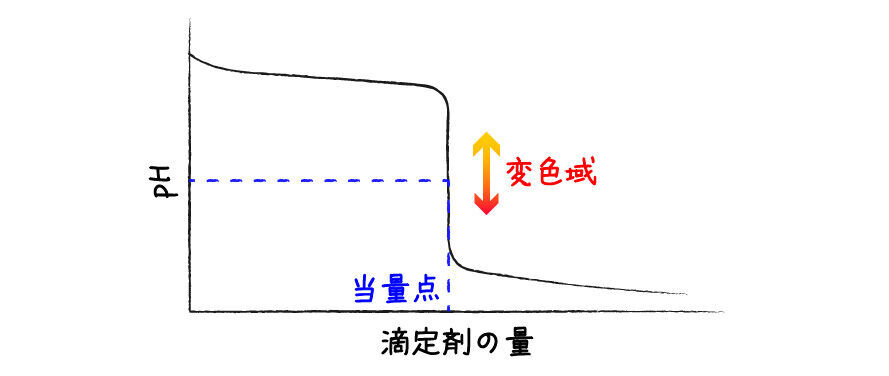
最も簡単なのはpHによって色が変化する指示薬を用いることです.指示薬の色が変化した点で滴定を終了します.このような点を終点と呼びます.

終点と当量点は通常,一致しません.指示薬の色が変化するpH範囲(変色域)と当量点でのpHが異なっているともちろんずれるのですが,指示薬の色変化には幅があるので人によっては判断がわかれてしまいますし,そもそも指示薬の色変化のためにも滴定剤が消費されて誤差を生じてしまいます.
そこで終点と当量点の差を小さくするため,なるべく変色域が当量点に近い指示薬を選択することが重要です.
また,補正のためにサンプルの入っていないただの水のような溶液を用いてあらかじめブランク滴定を行うことでより正確性を高めることもできます.
一方,滴定を正確に行うには滴定剤の濃度を正確に求めておくことも必要です.
滴定剤として,十分に純粋な試薬を正確にはかりとって調製した溶液を使うことができれば正確ですね.このような試薬を一次標準物質と呼びます.一次標準物質は純度99.9%以上で,通常の貯蔵では分解しないことが求められます.
中和滴定では炭酸ナトリウムNa2CO3などがそれに該当します.一方でNaOHやKOHは吸着水を含んだり,大気中のCO2と反応して炭酸塩を生成してしまうので不適当です.
一次標準物質でない物質を滴定剤として用いる場合,事前に一次標準物質を用いた滴定によって滴定剤の濃度を決定しておくことが必要です.このような操作を標定と呼び,標定によって濃度が決定された滴定剤を標準液と呼びます.
以上の点に気をつけて実験すれば,中和滴定によってサンプル中の酸やアルカリの濃度を正確に推測することができます.
2.中和滴定の誕生
はじめのうちは,酸の濃度を調べるときに指示薬は使われていませんでした.代わりに用いられたのが発泡現象です.

1658年,ドイツの化学者グラウバー (Johann Rudolf Glauber, 1604-1670)は純粋な硝酸カリウムを硝酸HNO3と炭酸カリウムK2CO3から作る反応について,次のように述べています.
(炭酸カリウムについて)さらに添加しても泡の発生が起こらず,相反する性質が失われ,互いに殺し合うようになるまで,硝酸に一滴ずつ加えなければならない.
この反応では二酸化炭素の泡が発生しますので,泡の発生が止まるタイミングを反応の完了とみなしたわけです.
1729年,フランスの薬学者ジョフロワ (Claude Joseph Geoffroy, 1685-1752) は発泡現象を用いて酢の強さを調べる方法を報告しました*2.

彼は濃度不明の酢を量り取り,徐々に炭酸カリウムK2CO3を少しずつ加えました.そうすると二酸化炭素の泡が発生します.
泡が発生しなくなるまでにどのくらい加えたかを調べれば,酸の強さがわかるというものです*3.パリの弱い酢*4では0.26 gくらい,オルレアン *5の強い酢では0.77 gくらい消費したようです.
グラウバーは単に反応の完了を知るために発泡現象を用いましたが,ジョフロワは酸の強さを定量的に比較するために発泡現象を用いた点が新しいです.中和滴定の原型といえます.
同様の現象は,アルカリの濃度を調べるのにも使えます.
1747年,フランスの博物学者ルモニエ (Louis-Guillaume Le Monnier, 1717-1799) はBarèges*6の温泉水に含まれるアルカリ土類の濃度を調べるため,約30Lの水を蒸発させて残った残留物に硫酸H2SO4を一滴ずつたらし,発泡させました.
発泡現象が終わるまでに硫酸を何滴加えたかを鉱水サンプルそれぞれについて調べることにより,鉱水に含まれるアルカリ土類の量を比較しました.
このように,ジョフロワは「(アルカリの)粉末を何g加えたか?」で,ルモニエは「硫酸を何滴加えたか?」で評価し酸やアルカリの濃度を評価しました.つまり,現代の中和滴定のように滴定剤で対象物の濃度を調べていたことになります.
しかし「何滴か?」では厳密さに欠けている気もします.人や器具によって違いそうですしね.

1756年,エジンバラ大学のFrancis Home (1719-1813) は自身の本の中で,5種類の植物灰に含まれるアルカリ(炭酸カリウムK2CO3)の量を定量するため,硝酸を水で7倍に希釈した酸溶液をスプーンで少しずつ加えるという方法を記述しました.ある灰では,泡の発生が終わるまでにスプーン12杯分の酸溶液が必要だったようです.
Homeは濃度既知の酸を「スプーン何杯加えたか?」で評価,すなわち加えた酸の体積で評価していますので,より現在の中和滴定の形に近いといえます.
一方,発泡現象の代わりに指示薬の色変化を用いる方法も提案されました.
1767年にWilliam Lewisは,アメリカ産の樹木灰(ポタシュ)に含まれる炭酸カリウムK2CO3の量を評価する方法を著した本を出版しました.
当時,アメリカ産の炭酸カリウムは木灰から作られていましたが,業者によっては海水を使って製造していたため,塩が混じる場合がありました.そのため純度の測定が重要でした.
【参考】アルカリの歴史(4):炭酸カリウム
彼はポタシュに含まれる炭酸カリウムを調べる方法として,指示薬を用いる方法を記述しています*7.
カリ試料(炭酸カリウムK2CO3)中の土壌物質や石灰や間違って混入した野菜の灰は,アルカリ性の塩と同じように酸を消費する.そのため,試料は水に溶かし,ろ過し土壌を分離する.(中略)さらに,泡の発生の終結に基づいて中和点を決めるのは正確さが足りないので,ある種の野菜汁,または汁を染み込ませた紙の色の変化のような,明瞭で鋭敏な現象によって決定すべきである.砂糖を包むのに使っている上質の紫青色の紙はこの目的に適している.
ここで触れられている「砂糖を包むのに使っている上質の紫青色の紙」というのは,リトマス紙のことです.主にオランダで製造されたリトマスで染められた紙は砂糖の包装紙などに使われていました.
【参考】酸の歴史(1):酸とはなにか?
あらかじめリトマス紙を短冊状に切断し*8,その片方の端を弱い酸で赤色にしておきます.赤色の端は溶液がまだアルカリ性かどうかを,青色の端は中和されて酸性に傾きはじめたかどうかを調べるのに使われました.

彼はまず,0.125オンスの純粋な炭酸カリウムを用意し,これを中和するのにちょうど4オンス必要になるように塩酸を希釈しました.
そしてこれをアメリカ産の炭酸カリウムに用いることで,どれくらいの純度なのかを調べたというわけです.
1806年にはFrançois-Antoine-Henri Descroizilles (1751-1825) がアルカリメーターと呼ばれる,現在のビュレットの原型となったガラス器具を導入した,より簡単な方法を発表しました.標準液である希硫酸を加え,スミレの抽出液の色が変わるまでに必要となった希硫酸の体積を記録しました.
彼はこの方法によって数千回も実験を行ったそうです.
このようにして,指示薬を用いた中和滴定法が成立しました.
3.中和滴定の応用
こうして誕生した中和滴定は,水質調査や化学工業などで使われました.

18世紀末当時,水に酸やアルカリが含まれているかどうかは味によって簡便に判定されていました.より正確に調べるには,水を蒸発させてアルカリの結晶を得て,その重さを量ることが古くから行われていました.
しかしながら鉱水中には重さを量れるほどアルカリが含まれていない場合もありました.そのような場合,酸を用いて中和滴定が実施されました.化学者であればみんな行うような方法になっていました.
蒸発によって得られた結晶についても,より詳細にアルカリの量を定量するために中和滴定が行われることもありました.
蒸発残留物にはNa2SO4,NaCl,Na2CO3が含まれています.これを水に溶かし直し,そしてもう一度蒸発させて結晶を得ます.ここに酢酸CH3COOHを少しずつ加え,リトマス抽出液を指示薬として中和滴定を行いました.
滴定に用いた酢酸は,純粋な炭酸ナトリウムNa2CO3*9によって標定,つまり酸の強さを測定しました.
こうすることで,水中に含まれるアルカリ,主にNa2CO3の量を定量することができました.
また,中和滴定は化学工業においても重要な役割を果たしました.

18世紀ヨーロッパでは戦争が絶えず,兵器として重要な火薬に使われる硝石KNO3の製造が重要な課題でした.特にフランスは硝石が自然に産出するインド開発に出遅れ,七年戦争 (1754-1763) で貴重なフランス領インドを失ってしまい,自給自足が課題となっていました.
フランスでは石造りの建物や厩舎の壁などに自然に生じた塩っぽいものを必死にかき集め*10,これを精製して硝石を製造しました.1669年から1775年の期間では年間70万-180万kg生産されていたようです.
原料となる硝石は純粋なKNO3というわけではなく,吸湿性の高い硝酸カルシウムCa(NO3)2などが含まれていました.これが残っていると爆薬としての性能が損なわれてしまいます.そのため,硝石を製造する工程では粗製硝石溶液に含まれるカルシウムなどを除去することが重要でした.
そこで硝石製造の際には,粗製硝石溶液に樹木の灰,具体的には炭酸カリウムK2CO3を加えてカルシウム塩を沈殿させるという操作が古くから慣習的に行われていました.
溶解度の差をうまく使うことで,硝石だけを母液に残しておくことができます.
ここで問題となるのは,母液に不純物として含まれる塩化カリウムKClです.何も考えずにK2CO3を大量に加えてしまうとKClもできてしまいます.
これをK2CO3から取り除くのはなかなか大変です.
KClを生じさせずにKNO3のみ生成させるには,硝酸イオンNO3-の量をあらかじめ調べておき,ちょうどその分だけCaCO3として沈殿させられるようにK2CO3を加えれば良いです.
ではどのように硝酸イオンの量を調べれば良いでしょうか?

1782年,ブルゴーニュの硝石工場の経営者でもあったド・モルボー(Louis-Bernard Guyton de Morveau, 1737-1816)は,滴定により硝酸イオンの濃度を調べる方法を報告しました.
母液にはCl-とNO3-が含まれていますので,まずはこの二つが合計でどの程度含まれているか,滴定によって調べます.
はじめに母液サンプルにスオウやキョウオウの抽出物で染めた紙片を入れ,既知濃度の炭酸ナトリウム水溶液を添加します.
$
紙片の色が変わった時点で滴定を終了すれば,Cl-とNO3-の合計量がわかります.
中和滴定か?といわれると微妙なラインですが,指示薬で液性を見ながら滴定量を決定しているので中和滴定として解説されることが多いようです.
次に,新しく用意した母液サンプルに既知濃度の硝酸鉛Pb(NO3)2水溶液を添加します.
すると白い塩化鉛PbCl2の沈澱が生じます.沈澱が生じなくなる時点で添加を終了すれば,Cl-の量がわかります.これはいわゆる沈澱滴定ですね.
【3/5予定】滴定の歴史(9):沈殿滴定
以上の結果から「Cl-とNO3-の合計量」と「Cl-の量」がわかるので,「NO3-の量」を計算することができるというアイデアです.
このように,細かい作業に不慣れな労働者でも指示薬や沈澱反応といった見た目の変化でわかりやすく作業ができる分析手法として滴定法を用いた方法が提案されました.
実際にパリの硝石工場で試験が行われたようでしたが,方法としてはまだ不完全で,実施には困難もあったようです*11.
一方,石鹸製造業においては原料となるアルカリ,具体的には炭酸ナトリウムNa2CO3の純度が問題となりました.

下手をすれば,騙されて高値で低品質の原料を買い付けることになってしまいます.
当時,石鹸業者は見た目と味(!)によって原料の純度を判断していましたが,これでは不正確です.そこでLaurensは化学に疎い業者でも簡単に導入できる方法として,中和滴定を用いて炭酸ナトリウムの純度を定量する方法を提案しました.
まず,サンプルを水に完全に溶かしきります.次に塩酸を徐々に加えていきます.
中和が完了した際に,それまでに消費した塩酸の重量を測定したようです.塩酸の濃度そのものは,純粋な炭酸ナトリウムで標定しました.
4.中和滴定の改良
ブラック(Joseph Black, 1728-1799)は1791年,中和滴定に関する重要な研究を発表しました.

彼はリトマス抽出液の色変化を指標にアイスランドの温泉水に含まれるアルカリの量を硫酸で滴定して調べようとしていたのですが,赤く色変化して「滴定が終わった!」と思ってもしばらくすると青色に戻ってしまったのです.原因は二酸化炭素CO2でした。
ぎりぎりを狙って中和させた場合,溶液中のCO2が抜けると塩基性に傾いてしまうのです。
そこで彼は一旦,溶液を酸性に振り切ってから,逆向きに滴定することにしました.
水中のアルカリ含有量をリトマス抽出液を指示薬として中和滴定で調べる際に,まず希硫酸を過剰に加えます.このとき,発生したCO2は煮沸することで追い出します。
次に,加えた希硫酸がどれくらい過剰だったかを,今度は炭酸ナトリウムで滴定します.今度は多少CO2が抜けても,さらに塩基性になるだけなので色変化に影響はありません。
こうすることで,指示薬の色変化を活用して正確にアルカリ含有量を計算することができました.このように,どれくらい過剰だったかを滴定によりさらに調べる方法を逆滴定といいます.
ブラックの方法のすごかった点は他にもあります.
リトマス抽出液自身は,実は弱アルカリ性を示します*12.そこでブラックはあらかじめリトマス抽出液を中和するのに必要な希硫酸の量を調べておいて,これを先程の滴定実験で求めた硫酸量から差し引くという補正を行いました.これにより,中和滴定の精度が格段に向上しました.
ブラックが発明した逆滴定というテクニックは,アンモニアの分析にも応用されました.
1847年,E.M. Peligotは気体のアンモニアの量を調べるために,まずアンモニアを過剰量の塩酸中に通じました.
次に,まだ残っている塩酸の量を石灰水*13で逆滴定しました.
指示薬にはアルカリ性で紫色に変化する鉄とタンニン酸の化合物を用いました.
こうすることで,液体でなく気体でもその量を中和滴定によって調べることができるようになりました.
逆滴定を利用した面白い例が,1846年にリヨン大学のAmand Bineau (1812-1861)が報告した,土壌中の炭酸カルシウムCaCO3含有量を測定する方法です.
まずサンプル溶液に塩酸などの酸を少し過剰になるように加え.このとき,溶液を加熱して二酸化炭素を追い出しておきます.
次に,水酸化ナトリウムNaOHで逆滴定します.
これでアルカリの量がわかります.アルカリとしてCaCO3のみを含む場合はこれでOKですが,CaCO3のほかにMgCO3も含まれている場合,これもアルカリとしてカウントされてしまいます.
そこで今度はサンプル溶液に砂糖を加え,さらに過剰に水酸化ナトリウム溶液を加えます.Ca(OH)2は砂糖水に溶けやすいので,Mg(OH)2のみが溶けきれずに沈殿します.
そこでこれをろ過により取り除いたあと,過剰のアルカリを塩酸などの酸で滴定すればMgCO3の量がわかります.
砂糖水に対する溶解度の差を用いた,かしこいやり方と言えるでしょう.
さて,中和滴定で用いる標準液にはそれぞれ色んな濃度の溶液が使われていました.しかし濃度がバラバラでは,化学者間でデータを共有しようと思うといちいち換算し直さなければいけないのでちょっと面倒です.
基準となる濃度で作った標準液,特に規定液を導入したのはイギリスの化学者Andrew Ure (1778-1857)ではないかと言われています.
Ureは1801年にアンダーソン大学の化学と博物学の講師となり,1830年からはロンドンに移り住み,化学分析や工業コンサルタントを行っていました.
Ureは労働者のための一般的な講演を数多く行いました.労働者がわずかでも科学的知識を持てば,生産量が高まるという信念があったようです.
化学知識の普及を目的として彼が取り組んだのは,科学辞典の作成です.中でも1837年に発刊した『Dictionary of Arts, Manufactures and Mines』の出来は素晴らしく,存命中だけでなく死後も改訂が重ねられました.
Ureは1844年に改訂した際にアルカリ滴定の章を設け,40グレインの硫酸を1000グレインで中和するアンモニア水の希釈方法を追記しています.40グレインというのは,当時考えられていた硫酸の"原子量"でした.彼自身は1815年頃からDaltonが報告した"原子量"*14に基づいて標準液を調製していたようです.
一説には,フランスでは19世紀にメートル法が普及して比較的換算がしやすかったのに対して,イギリスではメートル法が採用されなかったので計算が面倒で,「じゃあ濃度を共有しておけば換算の面倒臭さは解消されるよね」となったのではないかと考えられています.
このようにして導入された"原子量"を利用した規定液は,ドイツの化学者モール(Karl Friedrich Mohr, 1806-1879)が1855年に著した『化学分析滴定法の教科書 (Lehrbuch der chemisch-analytischen Titrimethode)』によって広まりました.

モールの中和滴定では,酸としてシュウ酸を用いました.これは,シュウ酸が固体であり,正確な標準溶液を作りやすかったためです.
アルカリ金属塩の場合はシュウ酸でOKですが,アルカリ土類金属塩の場合,シュウ酸と不溶性の塩をつくるので不適です.そこでその場合は,仕方なく硝酸の標準液を用いていました.
5.まとめ
理科実験でお馴染みの中和滴定ですが,意外な歴史がありましたね.
次は中和滴定の成功に欠かせない,測定方法について見てみましょう.
参考文献
"ULLMANN'S Encyclopedia of Industrial Chemistry" Wiley-VCH Verlag GmbH & Co. KGaA (2002).
"History of Analytical Chemistry" F. Szabadváry, Pergamon press (1966).
"The Development of Titrimetric Analysis till 1806" E. R. Madsen (1958).
"Sur l'emploi des soudes dans les fabriques à savon de Marseille" M. Laurens, Annales de chimie, 67, 97-106 (1808).
"Origin of Standard Solutions" F. Sabadváry, Chemist and Druggist, 168, 616 (1957).
"Dosage du carbonate de chaux." M. Bineau, Journal de pharmacie et de chimie. 12, 301-303 (1847).
"XIX. Alkalimetry with Phenol Phthalein as Indicator" R.B. Warder, American chemical journal 3, 55-58 (1881).
"Kritische Studien zur volumetrischen Bestimmung von karbonathaltigen Alkalilaugen und von Alkalikarbonaten, sowie über das Verhalten von Phenolphtaleïn und Methylorange als Indikatoren" F.W. Küster, Zeitschrift für anorganische Chemie, 13, 1-448 (1897).
“Sur un nouveau mode de dosage des Nitrates, et particulièrement du Salpêtre” J. Pelouze, Annales de chimie et de physique, 20, 129-143 (1847).
“The French Crash Program for Saltpeter Production, 1776-94” R.P. Multhauf, Technology and Culture, 12, 163-181 (1971).
『ハリス分析化学』D.C. Harris, 化学同人 (2017).
『分析化学の歴史』F. Szabadváry (1988).
"酢酸菌利用の歴史と食文化" 外内 尚人,日本乳酸菌学会誌,26, 6-13 (2015).
*1:たいていはこれを体積で表示します.しかしながら体積では精度が悪いので,重量で測定するべきだという考え方もあります.そういった人たちから言わせれば,「容量分析に使うガラス器具は,過去のものとして博物館に展示されるべきだ」ということになります.
*2:強い酢であればいろんな実験に使えたので,強さが知りたかったようです.
*3:このアイデア自体はHomberg (1699) にさかのぼることができます.
*4:パリの酢はブドウのコンディションによって混ぜ物がしてあったようです.
*5:オルレアンでは1394年に世界最古の酢生産企業が誕生し,高級ワインビネガーとしてのブランドを確立しました.
*6:ルイ14世に仕えた陸軍大臣フランソワ=ミシェル・ル・テリエ (François-Michel le Tellier, Marquis de Louvois, 1641-1691)が足の骨折を治すためにこの地を訪れ,のちに軍事病院を建設しました.1744年にはTarbesと結ぶ道路が開通し,浴場の整備が進んでいました.
*7:彼は「アルカリ性の溶液の飽和(中和)に必要な酸の量は,液滴やスプーンの数ではなく,秤量によって測定すべきである.」と書いていますが,実際には二酸化炭素の分軽くなりますので微妙なところでしょう.
*8:もしかしたら現在の細長いリトマス紙の形は,ここからきているのかもしれませんね.
*9:純粋な炭酸ナトリウムは,一度酢酸で中和したあと,精製した酢酸ナトリウムCH3COONaをアルコールで抽出し,加熱することで得ていました.
*10:特にフランス革命後は革命の中心となったサン・キュロットたちが硝石の採集を頑張っていました.その結果,「フランスの第二次作戦のための火薬が不足しているという噂をサン・キュロットが無効化した」とまで言わしめました.
*11:特に2つめの沈殿反応を用いた滴定は,あまりにも反応が遅く,使い物にならなかったようです.
*12:指示薬自身が中和滴定に影響することは1750年,Venelが見出していました.Venelはゼルツ産の鉱水を中和滴定で分析する際にスミレの抽出液を用いていました.ゼルツ産の水0.5ポンドに希釈した硫酸(標準液)を加えていったところ,1.79 g加えたところで色が消えたようです.雪解け水でも同様の結果が出ましたので,この1.79 gという量はスミレの抽出液,いわば指示薬の変化に使われたものだと推論されました.
*13:カルラーラ産の大理石を加熱して水でどろどろにし,溶液が透明になるまで砂糖を加えることで作成しました.砂糖を加える理由は,Ca(OH)2が溶けやすくなるからです.Ca(OH)2の溶解度は,砂糖の濃度が濃くなるほど上昇することが知られています.
*14:現在の意味とは異なります.今で言う分子量に近い概念です.